题目内容
【题目】氨气在产生、生活中都有广泛用途,所以,化学学习中对氨气认识十分重要。
(1)已知H-H键、N-H键、N≡N键的键能分别是436kJ/mol、391kJ/mol、946kJ/mol,合成氨的热化学方程式为_____________。
(2)下列方法可以证明 N2(g)+3H2(g)![]() 2NH3(g)已达平衡状态的是____。
2NH3(g)已达平衡状态的是____。
①单位时间内生成n mol H2同时生成n molNH3
②单位时间内3molH—H键断裂同时有6 mol H—N键断裂
③温度和体积一定时,容器内压强不再变化
④c(N2)︰c(H2)︰c(NH3)=1︰3︰2
⑤反应速率2v(H2)= 3v(NH3)
⑥条件一定,混合气体的平均相对分子质量不再变化
⑦温度和体积一定时,混合气体的密度不再变化
(3) 25 ℃时,将工业生产中产生的NH3溶于水得0.1mol/L氨水20.0 mL,测得pH=11,则该条件下,NH3H2O的电离平衡常数约为__________。向此溶液中加入少量的氯化铵固体时,[c(NH3H2O) c(H+)] / c(NH4+)值将______(“增大”“减小”或“不变”)。
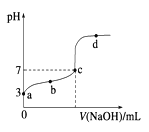
(4)若向该氨水中逐滴加入等浓度的盐酸,溶液中pH与pOH(pOH=-lg[OH-])的变化关系如图所示。

B点所加盐酸的体积_____(填“>”、“=”或“<”) 20.0 mL。C点溶液中离子浓度大小顺序为_____>____>_____>_____。
(5)常温下,向0.001mol/LAlCl3溶液中通入NH3直至过量,当pH=_________时,开始生成沉淀(已知:Ksp[Al(OH)3]=1.0×10-33)。
【答案】 N2(g)+3H2(g)![]() 2NH3(g) △H=-92kJ/mol ②③⑥ 10—5 不变 < c(Cl—) c(NH4+) c(H+) c(OH—) 4
2NH3(g) △H=-92kJ/mol ②③⑥ 10—5 不变 < c(Cl—) c(NH4+) c(H+) c(OH—) 4
【解析】试题分析:(1)根据反应物总键能-生成物总键能=焓变,计算反应热;(2)根据化学平衡的定义判断平衡状态;(3)利用三段式计算氨水的电离平衡常数;向氨水中加入少量的氯化铵固体,氨水电离平衡逆向移动;(4) B点pH=pOH,溶液呈中性;C点溶pH<pOH,溶液呈酸性,根据电荷守恒判断离子浓度;(5)根据 Ksp[Al(OH)3]= 1.0×10-33计算开始生成沉淀时c(OH—);
解析:(1) N2(g)+3H2(g)![]() 2NH3,根据反应物总键能-生成物总键能=焓变,△H=946kJ/mol +3×436kJ/mol -6×391kJ/mol =-92kJ/mol,所以合成氨的热化学方程式为N2(g)+3H2(g)
2NH3,根据反应物总键能-生成物总键能=焓变,△H=946kJ/mol +3×436kJ/mol -6×391kJ/mol =-92kJ/mol,所以合成氨的热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) △H=-92kJ/mol;
2NH3(g) △H=-92kJ/mol;
(2)①单位时间内生成n mol H2同时生成![]() n molNH3,达到平衡状态,故①错误;②单位时间内3molH—H键断裂同时有6 mol H—N键断裂,说明N-H断裂和形成的数目相同,即NH3的物质的量保持不变,所以能证明该反应达到平衡状态,故②正确;
n molNH3,达到平衡状态,故①错误;②单位时间内3molH—H键断裂同时有6 mol H—N键断裂,说明N-H断裂和形成的数目相同,即NH3的物质的量保持不变,所以能证明该反应达到平衡状态,故②正确;
③该反应前后气体物质的量改变,温度和体积一定时,容器内压强不再变化,说明物质的量不再变化,一定平衡,故③正确;④c(N2)︰c(H2)︰c(NH3)=1︰3︰2时,浓度不一定不变,所以不一定平衡,故④错误;
⑤v正(H2)表示消耗H2的速率,v逆(NH3)表示消耗NH3的速率,且v正(H2):v逆(NH3)=3:2,说明向两个相反方向进行的程度相当,说明到达平衡状态,v(H2)= 3v(NH3),反应方向相同,不一定平衡,故⑤错误;
⑥根据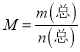 ,气体质量不变,气体物质的量是变量,所以M是变量,所以混合气体的平均相对分子质量不再变化,一定平衡,故⑥正确;
,气体质量不变,气体物质的量是变量,所以M是变量,所以混合气体的平均相对分子质量不再变化,一定平衡,故⑥正确;
⑦温度和体积一定时,根据![]() ,密度是恒量,混合气体的密度不再变化,不一定平衡,故⑦错误;
,密度是恒量,混合气体的密度不再变化,不一定平衡,故⑦错误;
(3)氨水溶液PH=11,则c(H+)═10-11 mol![]() L-1,c(0H-)═10-3mol
L-1,c(0H-)═10-3mol![]() L-1,
L-1,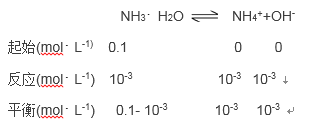
 10—5;
10—5;
[c(NH3H2O) c(H+)] / c(NH4+)=[c(NH3H2O) c(H+) c(OH-)] / c(NH4+) c(OH-),=![]() ,值不变;
,值不变;
(4) B点pH=pOH,溶液呈中性,若氨水和盐酸等物质的量混合,溶液呈酸性,所以B点盐酸的体积小于20.0 mL;根据电荷守恒![]() , C点溶pH<pOH,溶液呈酸性,所以c(Cl—)>c(NH4+)>c(H+)> c(OH—);
, C点溶pH<pOH,溶液呈酸性,所以c(Cl—)>c(NH4+)>c(H+)> c(OH—);
(5)根据 Ksp[Al(OH)3]= 1.0×10-33开始生成沉淀时c(OH—)= ![]() =10-10,所以c(H+)=10-4,PH=4。
=10-10,所以c(H+)=10-4,PH=4。

 名师点拨卷系列答案
名师点拨卷系列答案