题目内容
(1)带有2个单位正电荷的微粒ZAX2+,质量数A是137,中子数N是81,2.74g该微粒所含有的电子约为
(2)某元素最高价氧化物的化学式是RO2,已知其气态氢化物中含氢25%.
①计算R的相对原子质量为
②写出R最高价氧化物对应的水化物的化学式
1.08
1.08
mol.(2)某元素最高价氧化物的化学式是RO2,已知其气态氢化物中含氢25%.
①计算R的相对原子质量为
12
12
②写出R最高价氧化物对应的水化物的化学式
H2CO3
H2CO3
.分析:(1)根据物质的量的计算公式,质量数与质子数、中子数的关系求解.
(2)①根据R元素的化合价和氢元素百分含量去求解.
②根据最高化合价去书写.
(2)①根据R元素的化合价和氢元素百分含量去求解.
②根据最高化合价去书写.
解答:解:(1)ZAX2+的质量数为137,则其摩尔质量为137g/mol.n(X)=
=0.02mol.ZAX2+的质子数为:137-81=56,则电子数(形成阳离子要失去电子)为:56-2=54,即2.74g该微粒所含有的电子为:0.02mol×54=1.08mol.
(2)①在RO2中R呈+4价,则在氢化物中呈-4价,即氢化物是RH4,可得:
×100%=25%,故R的相对原子质量为:12.
②最高正价为+4,相对原子质量为12的元素是碳元素,则碳的最高价氧化物对应的水化物即碳酸的化学式是 H2CO3.
故答案为:(1)1.08;(2)12; H2CO3.
| 2.74g |
| 137g.mol |
(2)①在RO2中R呈+4价,则在氢化物中呈-4价,即氢化物是RH4,可得:
| 4 |
| R+4 |
②最高正价为+4,相对原子质量为12的元素是碳元素,则碳的最高价氧化物对应的水化物即碳酸的化学式是 H2CO3.
故答案为:(1)1.08;(2)12; H2CO3.
点评:本题应该根据常用的计算公式和常规知识去求解,一定要理清计算思路,做到步骤简练,思维清晰,答题规范.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
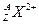 ,质量数A是137,中子数N
,质量数A是137,中子数N ,质量数A是137,中子数N
,质量数A是137,中子数N