题目内容
16.下列反应的离子方程式书写正确的是( )| A. | 氯化铁溶液与铜粉反应:Cu+Fe3+═Fe2++Cu2+ | |
| B. | 稀HNO3与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液与稀H2SO4反应:Ba2++SO${\;}_{4}^{2-}$═BaSO4↓ | |
| D. | 碳酸氢钙与盐酸反应:HCO${\;}_{3}^{-}$+H+═H2O+CO2↑ |
分析 A.电荷不守恒;
B.稀HNO3与铁粉反应生成NO;
C.生成硫酸钡和水;
D.碳酸氢钙与盐酸反应生成氯化钙、二氧化碳和水.
解答 解:A.电荷不守恒,反应的离子方程式为Cu+2Fe3+═2Fe2++Cu2+,故A错误;
B.稀HNO3与铁粉反应生成NO,反应的离子方程式为3Fe+8H++2NO3-═3Fe2++4H2O+2NO↑,故B错误;
C.生成硫酸钡和水,反应的离子方程式为Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故C错误;
D.碳酸氢钙与盐酸反应生成氯化钙、二氧化碳和水,反应的离子方程式为HCO3-+H+=CO2↑+H2O,故D正确.
故选D.
点评 本题考查较综合,涉及离子反应方程式书写、电离方程式书写及物质分类,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重化学用语考查,题目难度中等.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
6.短周期元素A、B、C原子序数依次递增,它们原子的最外层电子数之和为10,A与C同主族,B原子最外层电子数等于A原子次外层电子数,则下列叙述正确的是( )
| A. | 原子半径A<B<C | |
| B. | A的氢化物的稳定性大于C的氢化物 | |
| C. | A的氧化物是离子化合物,B的氧化物是共价化合物 | |
| D. | A与C可形成离子化合物 |
7.下列各组物质中,最简式相同,但既不是同系物,又不是同分异构体的是( )
| A. | 甲醛﹑甲酸甲酯 | B. | 丙烯﹑环丙烷 | C. | 乙酸﹑甲酸甲酯 | D. | 乙烯﹑1-丁烯 |
4.下列热化学方程式或说法正确的是( )
| A. | 甲烷的燃烧热为△H=-890kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890 kJ?mol-1 | |
| B. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为: N2(g)+3H2(g)$?_{500℃,30MPa}^{催化剂}$2NH3(g)△H=-38.6kJ?mol-1 | |
| C. | 已知:H2(g)+F2(g)═2HF(g);△H=-270 kJ/mol,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ | |
| D. | 在C中相同条件下,2 mol HF气体的能量小于1 mol氢气与1 mol氟气的能量总和 |
11.下列事实不能用勒夏特列原理解释的是( )
| A. | 开启啤酒瓶后,瓶中马上泛起大量泡沫 | |
| B. | 钢铁在潮湿的空气中容易生锈 | |
| C. | 工业上生产硫酸的过程中,二氧化硫在接触室氧化时通入过量空气(O2) | |
| D. | 工业合成氨时常用通过量氮气的方法提高氢气的转化率 |
1.某物质灼烧时,焰色反应为黄色,下列判断正确的是( )
| A. | 该物质一定是钠的化合物 | B. | 该物质一定是金属钠 | ||
| C. | 该物质一定含钠元素 | D. | 该物质可能含钾元素 |
8.下列溶液中含氧原子最多的是( )
| A. | 10ml1.0 mol•L-1的H2SO4溶液 | B. | 20ml1.0 mol•L-1的Na2CO3溶液 | ||
| C. | 30ml1.0 mol•L-1的HNO3溶液 | D. | 40ml1.0 mol•L-1的NaOH溶液 |
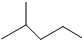 ,A的名称是2-甲基戊烷. 若A是炔烃B氢化而成,则B的结构有2种
,A的名称是2-甲基戊烷. 若A是炔烃B氢化而成,则B的结构有2种 和
和 F.
F. 和
和 G.
G. 和
和