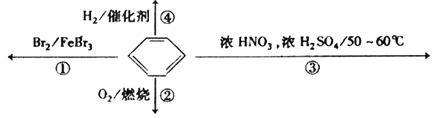
题目内容
【题目】在298 K、101 kPa下,将22 g CO2通入750 mL 1 mol·L-1 NaOH溶液中充分反应,测得反应放出x kJ热量。已知该条件下,1 mol CO2通入1 L 2 mol·L-1 NaOH溶液中充分反应放出y kJ热量。则CO2与NaOH溶液反应生成NaHCO3的热化学方程式为( )
A. CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(2y-x) kJ·mol-1
B. CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=(4x-y) kJ·mol-1
C. CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(4x-y) kJ·mol-1
D. CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=(2y-x) kJ·mol-1
【答案】C
【解析】
根据题意,22gCO2通入750mL 1molL-1NaOH溶液中充分反应,n(CO2)=![]() =0.5mol,n(NaOH)=1molL-1×0.75L=0.75mol,该反应既生成碳酸钠又生成碳酸氢钠,方程式为2CO2+3NaOH═NaHCO3+Na2CO3+H2O,由0.5molCO2反应放出热量为xkJ,则2molCO2反应放出热量为4xkJ,即热化学反应方程式为2CO2(g)+3NaOH(aq)═NaHCO3(aq)+Na2CO3(aq)+H2O(l) △H=-4xkJ/mol①,又1mol CO2通入1L 2molL-1NaOH溶液中充分反应放出y kJ的热量,则热化学方程式为2NaOH(aq)+CO2(g)═Na2CO3(aq)+H2O(l) △H=-ykJ/mol②,由盖斯定律可知,①-②可得,NaOH(aq)+CO2(g)═NaHCO3(aq) △H=-(4x-y)kJ/mol,故选C。
=0.5mol,n(NaOH)=1molL-1×0.75L=0.75mol,该反应既生成碳酸钠又生成碳酸氢钠,方程式为2CO2+3NaOH═NaHCO3+Na2CO3+H2O,由0.5molCO2反应放出热量为xkJ,则2molCO2反应放出热量为4xkJ,即热化学反应方程式为2CO2(g)+3NaOH(aq)═NaHCO3(aq)+Na2CO3(aq)+H2O(l) △H=-4xkJ/mol①,又1mol CO2通入1L 2molL-1NaOH溶液中充分反应放出y kJ的热量,则热化学方程式为2NaOH(aq)+CO2(g)═Na2CO3(aq)+H2O(l) △H=-ykJ/mol②,由盖斯定律可知,①-②可得,NaOH(aq)+CO2(g)═NaHCO3(aq) △H=-(4x-y)kJ/mol,故选C。

 科学实验活动册系列答案
科学实验活动册系列答案