题目内容
(1)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-24.8kJ·mol-1
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H=-47.4kJ·mol-1
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H=+640.5kJ·mol-1
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
。
(2)在压强为0.1 MPa条件下,容积为V L某密闭容器中a mol CO与 2a mol H2在催化剂作用下反应生成甲醇:CO(g)+2H2(g)  CH3OH(g);CO的转化率与温度、压强的关系如图所示。
CH3OH(g);CO的转化率与温度、压强的关系如图所示。

①该反应的△H 0 (填“<”、“>”或“=”)。
②在温度容积不变的情况下,向该密闭容器再
增加a mol CO与 2a mol H2,达到新平衡时,CO的转化率 (填“增大”、“减小”或“不变”)。
(3)实验室中配制AgNO3溶液时通常需要向其中加入 ,目的是 ; AgCl在水中存在沉淀溶解平衡:
AgCl(s) Ag+(aq)+Cl-(aq)。25oC时,现将足量AgCl分别放入:①l00mL蒸馏水;②l0 0mL 0.2 mol?L-1AgNO3溶液;③100mL 0.1 mol?L-1氯化镁溶液;④100mL 0.1 mol?L-1氯化钠溶液。充分搅拌后,相同温度下Ag+浓度由大到小的顺序是 (填写序号)。
Ag+(aq)+Cl-(aq)。25oC时,现将足量AgCl分别放入:①l00mL蒸馏水;②l0 0mL 0.2 mol?L-1AgNO3溶液;③100mL 0.1 mol?L-1氯化镁溶液;④100mL 0.1 mol?L-1氯化钠溶液。充分搅拌后,相同温度下Ag+浓度由大到小的顺序是 (填写序号)。
(1)CO(g)+FeO(s)===Fe(s)+CO2(g) △H=-218.0kJ/mol
(2)① <; ② 增大(3)硝酸 抑制Ag+水解
②①④③
【解析】
试题分析:(1)CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式为CO(g)+FeO(s)===Fe(s)+CO2(g) △H的计算如下,将3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g)加上Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) 乘以2,得到3Fe2O3(s)+ 3CO(g)=6FeO(s)+3CO2(g),化简得到Fe2O3(s)+ CO(g)=2eO(s)+CO2(g),
△H=1/3(-47.4kJ·mol-1+2×+640.5)=411.2kJ·mol-1,将Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)减去Fe2O3(s)+ CO(g)=2FeO(s)+CO2(g),化简得到2FeO(s)+2 CO(g)=2Fe(s)+2CO2(g) ,
△H=-24.8-411.2=-436kJ/mol,所以CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式为CO(g)+FeO(s)===Fe(s)+CO2(g) △H=-218.0kJ/mol;
(2)①由图可以知道,温度升高,CO的转化率减小,所以该反应为放热反应,故△H<0,②在温度容积不变的情况下,向该密闭容器再增加a mol CO与 2a mol H2,达到新平衡时,相当于增大压强,反应向正方向移动,所以CO的转化率增大;
(3)由于银离子易水解,所以配制AgNO3溶液时通常需要向其中加入硝酸,目的是抑制Ag+水解,AgCl(s) Ag+(aq)+Cl-(aq),在①l00mL蒸馏水;②l0 0mL 0.2 mol?L-1AgNO3溶液;③100mL 0.1 mol?L-1氯化镁溶液;④100mL 0.1 mol?L-1氯化钠溶液中,充分搅拌后,相同温度下Ag+浓度由大到小的顺序是②①④③。
Ag+(aq)+Cl-(aq),在①l00mL蒸馏水;②l0 0mL 0.2 mol?L-1AgNO3溶液;③100mL 0.1 mol?L-1氯化镁溶液;④100mL 0.1 mol?L-1氯化钠溶液中,充分搅拌后,相同温度下Ag+浓度由大到小的顺序是②①④③。
考点:热化学方程式的书写,化学平衡
点评:本题考查了热化学方程式的书写,化学平衡,第一小题的计算比较繁杂,后面两个小题比较容易。

 (1)盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列3个热化学反应方程式:
(1)盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列3个热化学反应方程式: CH3OH(g);CO的转化率与温度、压强的关系如图所示。
CH3OH(g);CO的转化率与温度、压强的关系如图所示。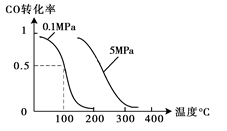
 Ag+(aq)+Cl-(aq)。25oC时,现将足量AgCl分别放入:①l00mL蒸馏水;②l0 0mL 0.2 mol?L-1AgNO3溶液;③100mL 0.1 mol?L-1氯化镁溶液;④100mL 0.1 mol?L-1氯化钠溶液。充分搅拌后,相同温度下Ag+浓度由大到小的顺序是 (填写序号)。
Ag+(aq)+Cl-(aq)。25oC时,现将足量AgCl分别放入:①l00mL蒸馏水;②l0 0mL 0.2 mol?L-1AgNO3溶液;③100mL 0.1 mol?L-1氯化镁溶液;④100mL 0.1 mol?L-1氯化钠溶液。充分搅拌后,相同温度下Ag+浓度由大到小的顺序是 (填写序号)。