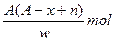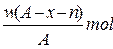题目内容
下列各项叙述中,正确的是 ( )
| A.电子层序数越大,s原子轨道的半径越大,形状发生明显的变化 |
| B.在同一电子层上运动的电子,其自旋方向肯定不同 |
| C.电负性的大小可以作为判断金属性和非金属性强弱的尺度 |
| D.原子最外层电子排布是5s1的元素,其氢氧化物不能使氢氧化铝溶解 |
C
本题考查原子结构与元素的性质。原子轨道的形状与电子层数的多少无关,s原子轨道的形状均为球形,只是半径大小不同,A项错误。同一原子轨道上运动的两个电子,自旋方向肯定不同;但同一电子层上运动的电子,其自旋方向有可能相同,B项错误。金属的电负性一般 小于1.8,非金属的电负性一般大于1.8,所以C项正确。D项错误,如Rb原子最外层电子排布为5sl,RbOH为强碱,能溶解Al(OH)3。
小于1.8,非金属的电负性一般大于1.8,所以C项正确。D项错误,如Rb原子最外层电子排布为5sl,RbOH为强碱,能溶解Al(OH)3。
 小于1.8,非金属的电负性一般大于1.8,所以C项正确。D项错误,如Rb原子最外层电子排布为5sl,RbOH为强碱,能溶解Al(OH)3。
小于1.8,非金属的电负性一般大于1.8,所以C项正确。D项错误,如Rb原子最外层电子排布为5sl,RbOH为强碱,能溶解Al(OH)3。
练习册系列答案
相关题目

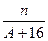 (A-N+8)mol
(A-N+8)mol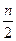 (A-N+6)mol
(A-N+6)mol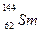 与
与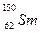 是同一种核素
是同一种核素 W
W