题目内容
在200mL稀硫酸和稀盐酸的混合溶液中,加入5.13g Ba(OH)2粉末,充分反应后过滤,得沉淀2.33g;又测知反应后的溶液中OH-的物质的量浓度为0.1mol?L-1.试求混合酸溶液中Cl-和SO42-的物质的量浓度.(假设反应前后溶液的总体积不变)
解:沉淀2.33g为硫酸钡的质量,则
n(SO42-)=n(H2SO4)=n(BaSO4)=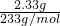 =0.01mol,
=0.01mol,
所以SO42-浓度为 =0.05mol/L;
=0.05mol/L;
反应后的溶液中OH-的物质的量为0.2L×0.1mol/L=0.02mol,
Ba(OH)2的物质的量为 =0.03mol,
=0.03mol,
则酸中总的n(H+)=0.03mol×2-0.02mol=0.04mol,
n(Cl-)=(HCl)=0.04mol-2n(H2SO4)=0.04mol-2×0.01mol=0.02mol,
则Cl-浓度为 =0.1mol/L,
=0.1mol/L,
答:混合酸溶液中Cl-浓度为0.1mol/L,SO42-的物质的量浓度为0.05mol/L.
分析:根据充分反应后过滤,得沉淀2.33g为硫酸钡的质量,氢氧根有剩余,酸完全反应,根据n= 计算硫酸钡的物质的量,利用H2SO4~BaSO4来计算SO42-浓度,根据c=
计算硫酸钡的物质的量,利用H2SO4~BaSO4来计算SO42-浓度,根据c= 计算SO42-的物质的量浓度;
计算SO42-的物质的量浓度;
利用n(H+)=n消耗(OH-)=2n[Ba(OH)2]-n剩余(OH-)计算原混酸溶液中氢离子物质的量,n(Cl-)=(HCl)=n(H+)-2n(H2SO4),再根据c= 计算Cl-的物质的量浓度.
计算Cl-的物质的量浓度.
点评:本题考查物质的量浓度的计算、离子反应的有关计算等,难度中等,注意根据酸碱中和时离子的关系来解答.
n(SO42-)=n(H2SO4)=n(BaSO4)=
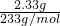 =0.01mol,
=0.01mol,所以SO42-浓度为
 =0.05mol/L;
=0.05mol/L;反应后的溶液中OH-的物质的量为0.2L×0.1mol/L=0.02mol,
Ba(OH)2的物质的量为
 =0.03mol,
=0.03mol,则酸中总的n(H+)=0.03mol×2-0.02mol=0.04mol,
n(Cl-)=(HCl)=0.04mol-2n(H2SO4)=0.04mol-2×0.01mol=0.02mol,
则Cl-浓度为
 =0.1mol/L,
=0.1mol/L,答:混合酸溶液中Cl-浓度为0.1mol/L,SO42-的物质的量浓度为0.05mol/L.
分析:根据充分反应后过滤,得沉淀2.33g为硫酸钡的质量,氢氧根有剩余,酸完全反应,根据n=
 计算硫酸钡的物质的量,利用H2SO4~BaSO4来计算SO42-浓度,根据c=
计算硫酸钡的物质的量,利用H2SO4~BaSO4来计算SO42-浓度,根据c= 计算SO42-的物质的量浓度;
计算SO42-的物质的量浓度;利用n(H+)=n消耗(OH-)=2n[Ba(OH)2]-n剩余(OH-)计算原混酸溶液中氢离子物质的量,n(Cl-)=(HCl)=n(H+)-2n(H2SO4),再根据c=
 计算Cl-的物质的量浓度.
计算Cl-的物质的量浓度.点评:本题考查物质的量浓度的计算、离子反应的有关计算等,难度中等,注意根据酸碱中和时离子的关系来解答.

练习册系列答案
相关题目