题目内容
某二元酸(H2A)在水中的电离方程式为:H2A=H++HA-,HA- H++A2-(Ka2=1.0×10-2),下列说法正确的是( )
H++A2-(Ka2=1.0×10-2),下列说法正确的是( )
 H++A2-(Ka2=1.0×10-2),下列说法正确的是( )
H++A2-(Ka2=1.0×10-2),下列说法正确的是( )分析:A、根据H2A第一步完全电离和物料守恒解答;
B、元酸(H2A)在水中的电离方程式为:H2A=H++HA-,HA- H++A2-(Ka2=1.0×10-2),第一步完全电离,第二步部分电离,根据平衡常数计算溶液的c(H+);
H++A2-(Ka2=1.0×10-2),第一步完全电离,第二步部分电离,根据平衡常数计算溶液的c(H+);
C、题中HA- H++A2-(Ka2=1.0×10-2),电离平衡常数较大,同浓度(0.1mol?L-1)的NaHA和Na2A溶液等体积混合,其pH应小于7;
H++A2-(Ka2=1.0×10-2),电离平衡常数较大,同浓度(0.1mol?L-1)的NaHA和Na2A溶液等体积混合,其pH应小于7;
D、0.1mol?L-1的NaHA溶液中,c(HA-)>c(H+);
B、元酸(H2A)在水中的电离方程式为:H2A=H++HA-,HA-
 H++A2-(Ka2=1.0×10-2),第一步完全电离,第二步部分电离,根据平衡常数计算溶液的c(H+);
H++A2-(Ka2=1.0×10-2),第一步完全电离,第二步部分电离,根据平衡常数计算溶液的c(H+);C、题中HA-
 H++A2-(Ka2=1.0×10-2),电离平衡常数较大,同浓度(0.1mol?L-1)的NaHA和Na2A溶液等体积混合,其pH应小于7;
H++A2-(Ka2=1.0×10-2),电离平衡常数较大,同浓度(0.1mol?L-1)的NaHA和Na2A溶液等体积混合,其pH应小于7;D、0.1mol?L-1的NaHA溶液中,c(HA-)>c(H+);
解答:解:A、二元酸(H2A)在水中的电离方程式为:H2A=H++HA-,HA- H++A2-(Ka2=1.0×10-2),可知第一步完全电离,第二步部分电离,则在0.1mol?L-1的Na2A溶液中,存在HA-和A2-离子,且c(A2-)+c(HA-)=0.1mol?L-1,又c(Na+)=0.2mol?L-1,所以c(A2-)+c(HA-)+2c(Na+)=0.5mol?L-1,故A正确;
H++A2-(Ka2=1.0×10-2),可知第一步完全电离,第二步部分电离,则在0.1mol?L-1的Na2A溶液中,存在HA-和A2-离子,且c(A2-)+c(HA-)=0.1mol?L-1,又c(Na+)=0.2mol?L-1,所以c(A2-)+c(HA-)+2c(Na+)=0.5mol?L-1,故A正确;
B、二元酸(H2A)在水中的电离方程式为:H2A=H++HA-,HA-=H++A2-(Ka2=1.0×10-2),第一步完全电离,第二步部分电离,设电离的HA-为x,则有:
=
,
解之得x=0.0084.所以在0.1mol?L-1的H2A溶液中,c(H+)=0.1mol/L+0.0084mol/L=0.1084mol/L,故B错误;
C、由Ka2=1.0×10-2知,HA-的电离度为10%,在温度不变时,同浓度(0.1mol?L-1)的NaHA和Na2A溶液等体积混合,溶液中的c(H+)近似为0.01mol/L,变化不大,溶液仍呈酸性,故C错误;
D、0.1mol?L-1的NaHA溶液中,HA-的电离程度约为10%,c(HA-)>c(H+),故D错误;
故选A.
 H++A2-(Ka2=1.0×10-2),可知第一步完全电离,第二步部分电离,则在0.1mol?L-1的Na2A溶液中,存在HA-和A2-离子,且c(A2-)+c(HA-)=0.1mol?L-1,又c(Na+)=0.2mol?L-1,所以c(A2-)+c(HA-)+2c(Na+)=0.5mol?L-1,故A正确;
H++A2-(Ka2=1.0×10-2),可知第一步完全电离,第二步部分电离,则在0.1mol?L-1的Na2A溶液中,存在HA-和A2-离子,且c(A2-)+c(HA-)=0.1mol?L-1,又c(Na+)=0.2mol?L-1,所以c(A2-)+c(HA-)+2c(Na+)=0.5mol?L-1,故A正确;B、二元酸(H2A)在水中的电离方程式为:H2A=H++HA-,HA-=H++A2-(Ka2=1.0×10-2),第一步完全电离,第二步部分电离,设电离的HA-为x,则有:
| (0.1+x)?x |
| (0.1-x) |
| 1 |
| 100 |
解之得x=0.0084.所以在0.1mol?L-1的H2A溶液中,c(H+)=0.1mol/L+0.0084mol/L=0.1084mol/L,故B错误;
C、由Ka2=1.0×10-2知,HA-的电离度为10%,在温度不变时,同浓度(0.1mol?L-1)的NaHA和Na2A溶液等体积混合,溶液中的c(H+)近似为0.01mol/L,变化不大,溶液仍呈酸性,故C错误;
D、0.1mol?L-1的NaHA溶液中,HA-的电离程度约为10%,c(HA-)>c(H+),故D错误;
故选A.
点评:本题考查弱电解质的电离平衡,涉及离子浓度大小比较,做题中注意外界条件对电离平衡的影响,利用电荷守恒、质量守恒解答此类题目.

练习册系列答案
相关题目

 、②
、② 、③
、③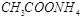 、
、
 由大到小的顺序是:①>②>③>④
由大到小的顺序是:①>②>③>④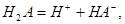
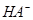

 则在NaHA溶液中:
则在NaHA溶液中:
