题目内容
对某酸性溶液(可能含有Br-,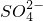 ,H2SO3,
,H2SO3,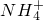 )分别进行如下实验:
)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色;
②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;
③加入氯水时,溶液略显黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸.
对于下列物质不能确认其在原溶液中是否存在的是
- A.Br-
- B.
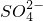
- C.H2SO3
- D.
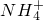
B
分析:①加热时放出的气体可以使品红溶液褪色,说明生成二氧化硫气体,说明溶液中含有H2SO3;
②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;证明气体是NH3,原溶液含有NH4+;
③加入氯水时,溶液略显黄色,证明溶液中含有Br-,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸,说明生成硫酸钡沉淀,但在硝酸溶液中亚硫酸可以被氧化为硫酸和氯化钡反应生成硫酸钡沉淀,不能确定原溶液中 是否含有硫酸根离子;
解答:①加热时放出的气体可以使品红溶液褪色,说明生成二氧化硫气体,说明溶液中含有H2SO3;
②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;证明气体是NH3,原溶液含有NH4+;
③加入氯水时,溶液略显黄色,证明溶液中含有Br-,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸,说明生成硫酸钡沉淀,但在硝酸溶液中亚硫酸可以被氧化为硫酸和氯化钡反应生成硫酸钡沉淀,不能确定原溶液中 是否含有硫酸根离子;
综上所述:根据实验①可知含有H2SO3,根据实验②确定含有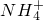 ,据实验③可推知有Br-,不能确定有无
,据实验③可推知有Br-,不能确定有无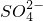 ,因H2SO3被氯水氧化成H2SO4.
,因H2SO3被氯水氧化成H2SO4.
故选B.
点评:本题考查了常见离子的检验方法和现象判断,关键是隐含离子的干扰作用,亚硫酸钡硝酸氧化为硫酸.
分析:①加热时放出的气体可以使品红溶液褪色,说明生成二氧化硫气体,说明溶液中含有H2SO3;
②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;证明气体是NH3,原溶液含有NH4+;
③加入氯水时,溶液略显黄色,证明溶液中含有Br-,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸,说明生成硫酸钡沉淀,但在硝酸溶液中亚硫酸可以被氧化为硫酸和氯化钡反应生成硫酸钡沉淀,不能确定原溶液中 是否含有硫酸根离子;
解答:①加热时放出的气体可以使品红溶液褪色,说明生成二氧化硫气体,说明溶液中含有H2SO3;
②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;证明气体是NH3,原溶液含有NH4+;
③加入氯水时,溶液略显黄色,证明溶液中含有Br-,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸,说明生成硫酸钡沉淀,但在硝酸溶液中亚硫酸可以被氧化为硫酸和氯化钡反应生成硫酸钡沉淀,不能确定原溶液中 是否含有硫酸根离子;
综上所述:根据实验①可知含有H2SO3,根据实验②确定含有
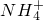 ,据实验③可推知有Br-,不能确定有无
,据实验③可推知有Br-,不能确定有无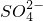 ,因H2SO3被氯水氧化成H2SO4.
,因H2SO3被氯水氧化成H2SO4.故选B.
点评:本题考查了常见离子的检验方法和现象判断,关键是隐含离子的干扰作用,亚硫酸钡硝酸氧化为硫酸.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
某化学兴趣小组在实验室对某固体催化剂(可能含有FeO、Fe2O3中的一种或两种)中铁元素的价态进行探究(已知:Fe2+能使高锰酸钾的酸性溶液褪色,反应式为:5 Fe2++MnO4—+8H+==5Fe3++Mn2++4H2O)。
(1)将该固体催化剂在稀硫酸中溶解,请写出这两种氧化物与稀硫酸反应的离子方程式:
、 。
(2)请完成对铁元素价态的探究:
限选实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹;
3 mol·L-1H2SO4,3% H2O2、6 mol·L-1HNO3、饱和氯水、0.01 mol·L-1KmnO4、0.1 mol·L-1KI、20% KSCN溶液、蒸馏水。
①提出合理假设
假设1: ;
假设2: ;
假设3:催化剂中铁元素的价态既有+3价又有+2价。
①设计实验方案证明你的假设(不要在答题卡上作答)
②实验过程
根据②的实验方案,进行实验。请在答题卡上按下表格式写出实验操作步骤、预期现象与结论。
| 实验操作 | 预期现象与结论 |
| 步骤1:将适量稀H2SO4加入少许样品于试管中,加热溶解;然后将所得溶液分置 于A、B试管中。 | 溶液呈黄绿色,说明溶液中含Fe2+或Fe3+。 |
| 步骤2: | |
| 步骤3: | |
| … |
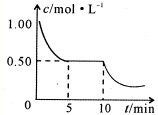
 学校化学研究小组对某溶液进行检测分析,该无色溶液中可能含有NH4+、K+、Al3+、HCO3-、Cl-、MnO4-、SO42-等离子中的几种离子.
学校化学研究小组对某溶液进行检测分析,该无色溶液中可能含有NH4+、K+、Al3+、HCO3-、Cl-、MnO4-、SO42-等离子中的几种离子.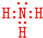
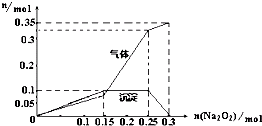 (2012?浙江模拟)学校化学研究小组对某溶液进行检测分析,该无色溶液中可能含有NH4+、K+、Al3+、HCO3-、Cl-、MnO4-、SO42-等离子中的几种离子.
(2012?浙江模拟)学校化学研究小组对某溶液进行检测分析,该无色溶液中可能含有NH4+、K+、Al3+、HCO3-、Cl-、MnO4-、SO42-等离子中的几种离子.