题目内容
1.亚氯酸钠(NaClO2)是一种重要的消毒剂,主要用于水、砂糖、油脂的漂白与杀菌.以下是制取亚氯酸钠的工艺流程如图1:
已知:①ClO2气体只能保持在浓度较低状态下以防止爆炸性分解,且需现合成现用.
②ClO2气体在中性和碱性溶液中不能稳定存在.
(1)在无隔膜电解槽中持续电解一段时间后,生成氢气和NaClO3,请写出阳极的电极反应方程式Cl--6e-+6OH-=ClO3-+3H2O.
(2)反应生成ClO2气体需要X酸酸化,X酸可以为B.
A.盐酸 B.稀硫酸 C. HI溶液
(3)吸收塔内的温度不能过高的原因为温度过高H2O2将分解.
(4)ClO2被S2-还原为ClO2-、Cl-转化率与pH关系如图2.写出pH≤2时ClO2与S2-反应的离子方程式:2ClO2+5S2-+8H+=2Cl-+5S↓+4H2O
分析 无隔膜电解槽中持续电解饱和氯化钠溶液,则电解生成的氯气和氢氧化钠反应生成氯酸钠溶液,通二氧化硫和X酸还原氯酸钠溶液生成二氧化氯,再用双氧水、氢氧化钠吸收反应生成亚氯酸钠,过滤的亚氯酸钠(NaClO2)溶液通过蒸发结晶得到亚氯酸钠晶体.
(1)电解槽中持续电解一段时间后,生成氢气和NaClO3,阳极上Cl失去电子;
(2)由于ClO2气体在中性和碱性溶液中不能稳定存在,所以只能在酸性环境中存在.由于在酸性条件下,氯酸钠容易和盐酸发生氧化还原反应,所以X应该是硫酸;
(3)H2O2不稳定,温度过高,H2O2容易分解,吸收塔的温度不能过高,其目的是防止H2O2分解;
(4)根据图象可知,pH≤2时ClO2被还原为Cl-.
解答 解:(1)电解池中阳极失去电子,所以溶液中的氯离子在阳极失去电子,因此反应的电极反应式是Cl--6e-+6OH-=ClO3-+3H2O,
故答案为:Cl--6e-+6OH-=ClO3-+3H2O;
(2)由于ClO2气体在中性和碱性溶液中不能稳定存在,所以只能在酸性环境中存在,由于在酸性条件下,氯酸钠容易和盐酸发生氧化还原反应,所以X应该是硫酸,故答案为:B;
(3)H2O2不稳定,温度过高,H2O2容易分解,吸收塔的温度不能过高,其目的是防止H2O2分解,故答案为:温度过高H2O2将分解;
(4)根据图象可知,pH≤2时ClO2被还原为Cl-,所以该反应的离子方程式是2ClO2+5S2-+8H+=2Cl-+5S↓+4H2O,故答案为:2ClO2+5S2-+8H+=2Cl-+5S↓+4H2O.
点评 本题考查物质的制备实验,为高考常见题型,把握制备流程及发生的反应为解答的关键,侧重于学生的分析能力和实验能力的考查,注意氧化还原反应、电解原理的应用,题目难度不大.

 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案| A. | 氢氧化钠溶液 | B. | 硫酸镁溶液 | C. | 食盐水 | D. | 硫酸溶液 |
| A. | 112 mL | B. | 224 mL | C. | 336 mL | D. | 448 mL |
| 实验编号 | 0.01mol•L-1酸性KMnO4溶液 | 0.1mol•L-1H2C2O4溶液 | 水 | 1mol•L-1MnSO4溶液 | 反应温度/℃ | 反应时间 |
| Ⅰ | 2mL | 2mL | 0 | 0 | 20 | 125 |
| Ⅱ | V1 mL | V2 mL | 1mL | 0 | 20 | 320 |
| Ⅲ | V3 mL | V4 mL | V5mL | 0 | 50 | 30 |
| Ⅳ | 2mL | 2mL | 0 | 2滴 | 20 | 10 |
(1)实验记时方法是从溶液混合开始记时,至紫红色刚好褪去时记时结束.
(2)实验I和Ⅱ研究浓度对反应速率的影响,实验Ⅰ和Ⅲ研究温度对反应速率的影响.则
V1=2V2=1V3=2V4=2V5=0.
(3)从实验数据分析,实验I和IV研究催化剂对反应的影响.
(4)请配平上面的化学方程式:
2KMnO4+5H2C2O4+ 3H2SO4= 1K2SO4+ 2MnSO4+10CO2↑+8H2O.
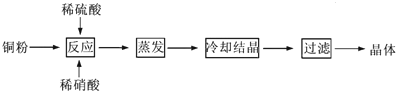
 ②实际生产过程中对所加稀硝酸的浓度控制要求比较高,通常用标准氢氧化钠溶液来滴定.滴定过程中若用酚酞作指示剂,终点现象是溶液由无色变成红色(或浅红色),且半分钟内不褪色.请在图中画出滴定过程中溶液的pH随所滴加氢氧化钠溶液体积的变化的曲线图(要求过A点).
②实际生产过程中对所加稀硝酸的浓度控制要求比较高,通常用标准氢氧化钠溶液来滴定.滴定过程中若用酚酞作指示剂,终点现象是溶液由无色变成红色(或浅红色),且半分钟内不褪色.请在图中画出滴定过程中溶液的pH随所滴加氢氧化钠溶液体积的变化的曲线图(要求过A点).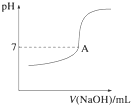 .
.