题目内容
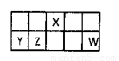
X、Y、Z、W为按原子序数由小到大排列的四种短周期的元素.其中Y、W位于同一主族,Z、W位于同一周期,Y的最外层电子数是K层电子数的3倍,Z是同一周期中金属性最强的元素,X的最外层电子数与Z相同,但X为非金属元素.请回答下列问题:
(1)Y、Z的元素符号分别是
(2)Z2W的电子式是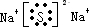
 ,X2Y的结构式为
,X2Y的结构式为

(3)Z2Y2与X2Y反应的化学方程式是:
(4)Z2WY3与X2WY4反应的离子方程式是:
(1)Y、Z的元素符号分别是
O
O
、Na
Na
.(2)Z2W的电子式是




(3)Z2Y2与X2Y反应的化学方程式是:
2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2H2O=4NaOH+O2↑
(4)Z2WY3与X2WY4反应的离子方程式是:
SO32-+2H+=SO2↑+H2O
SO32-+2H+=SO2↑+H2O
.分析:Y的最外层电子数是K层电子数的3倍,则Y的最外层电子数为6,X、Y、Z、W为按原子序数由小到大排列的四种短周期的元素,其中Y、W位于同一主族,则Y为O元素,W为S元素,Z是同一周期中金属性最强的元素,Z、W位于同一周期,则Z为Na元素,X的最外层电子数与Z相同,但X为非金属元素,则X为H元素,根据对应化合物的性质解答该题.
解答:解:(1)Y的最外层电子数是K层电子数的3倍,则Y的最外层电子数为6,X、Y、Z、W为按原子序数由小到大排列的四种短周期的元素,其中Y、W位于同一主族,则Y为O元素,W为S元素,Z是同一周期中金属性最强的元素,Z、W位于同一周期,则Z为Na元素,X的最外层电子数与Z相同,但X为非金属元素,则X为H元素,
故答案为:O;Na;
(2)Z2W为Na2S为离子化合物,电子式为 ,X2Y为H2O,为极性分析,分子为V形,结构式为
,X2Y为H2O,为极性分析,分子为V形,结构式为 ,
,
故答案为: ;
; ;
;
(3)Na2O2与H2O反应生成NaOH和O2,反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑,故答案为:2Na2O2+2H2O=4NaOH+O2↑;
(4)Na2SO3与H2SO4反应生成SO2,反应的化学方程式为,Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,反应实质为:SO32-+2H+=SO2↑+H2O,故答案为:SO32-+2H+=SO2↑+H2O.
故答案为:O;Na;
(2)Z2W为Na2S为离子化合物,电子式为
 ,X2Y为H2O,为极性分析,分子为V形,结构式为
,X2Y为H2O,为极性分析,分子为V形,结构式为 ,
,故答案为:
 ;
; ;
;(3)Na2O2与H2O反应生成NaOH和O2,反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑,故答案为:2Na2O2+2H2O=4NaOH+O2↑;
(4)Na2SO3与H2SO4反应生成SO2,反应的化学方程式为,Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,反应实质为:SO32-+2H+=SO2↑+H2O,故答案为:SO32-+2H+=SO2↑+H2O.
点评:本题考查位置结构性质的相互关系,题目难度中等,本题中推断难度不大,注意物质的电子式和结构式的书写,学习中把握物质的性质,牢固掌握有关反应的离子方程式或化学方程式的书写.

练习册系列答案
相关题目
X、Y、Z、Q、W为按原予序数由小到大排列的五种短周期元素。已知:①X与Q处于同一主族,其原子价电子排布式都为ns2np2,且X原子半径小于Q;②Y元素是地壳中含量最多的元素;W元素的电负性路小于Y元素,在W原子的价电子排布式中,p轨道上只有1个未成对电子;③Z元素的电离能数据见下表(kJ·mol-1)
|
I1 |
I2 |
I3 |
I4 |
… |
|
496 |
4562 |
6912 |
9540 |
… |
请回答:
(1)XY2分子的空间构型为 。
(2)QX的晶体结构与金刚石的相似,微粒间存在的作用力是 。
(3)晶体ZW的熔点比晶体XW4明显高的原因是 。
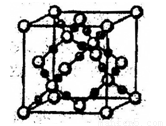
(4)XY2在高温高压下所形成的晶胞如图所示。该晶体的类型属于 (选填“分子”、“原子”、“离子”或“金属”)漏体,该晶体中X原子的杂化形式为___ 。
(5)氧化物MO的电子总数与QX的相等,则M为 。(填元素符号);MO是优良的耐高温材料,其晶体结构与ZW晶体结构相似,MO的熔点比CaO的高,其原因是 。