题目内容
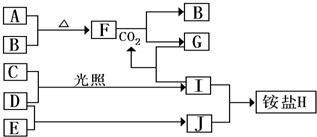
下图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金属单质,且在常温常压下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;
请完成下列填空:
(1)H的化学式 、F的电子式 。
(2)F和CO2的化学方程式 。写出G溶液中逐滴加入等物质的量的I溶液反应的离子方程式 。
(3)A与B 在加热条件下反应的主要现象是 ;检验H 中阳离子的方法是 。
(1) NH4Cl 、
(2) 2Na2O2+2CO2=2Na2CO3+O2 。 CO32- + H+ = HCO3-
(3)剧烈反应,火焰为黄色,生成淡黄色的固体;
取少量H 样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子。
解析试题分析:C、D在光照下发生反应,又由题意得它们是非金属单质,可得二者是H2和Cl2,则I是HCl,I和J反应得到铵盐可知J是NH3,H是NH4Cl,从而可确定C是Cl2,D是H2,E是N2。由化合物G的焰色反应为黄色,可知G为钠盐,又由题意得B是非金属单质,可是B是O2,A是Na,则F是Na2O2,G是Na2CO3
(1)由上面的推导过程可得H的化学式是NH4Cl,F是Na2O2,其电子式为: (2)Na2O2 和CO2反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2 ,Na2CO3溶液中逐滴加入等物质的量的HCl溶液反应的离子方程式是CO32- + H+ = HCO3- (3)Na和氧气在加热条件下的反应现象为:剧烈反应,火焰为黄色,生成淡黄色的固体。H是NH4Cl,其中的阳离子是NH4+,检验方法是:取少量H 样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子。
(2)Na2O2 和CO2反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2 ,Na2CO3溶液中逐滴加入等物质的量的HCl溶液反应的离子方程式是CO32- + H+ = HCO3- (3)Na和氧气在加热条件下的反应现象为:剧烈反应,火焰为黄色,生成淡黄色的固体。H是NH4Cl,其中的阳离子是NH4+,检验方法是:取少量H 样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子。
考点:Na的化合物的相关性质,铵盐的性质
点评:本题考察了无机化合物的相关知识,题目的难度一般,推断的过程也较为简单,学生需抓住各个物质之间发生反应时的联系。

 下图是部分短周期元素的常见化合价与原子序数的关系图,下列说法正确的是( )
下图是部分短周期元素的常见化合价与原子序数的关系图,下列说法正确的是( ) 下图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B,C,D,E是非金属单质,且在常温下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种重要固氮反应.请回答下列问题:
下图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B,C,D,E是非金属单质,且在常温下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种重要固氮反应.请回答下列问题: