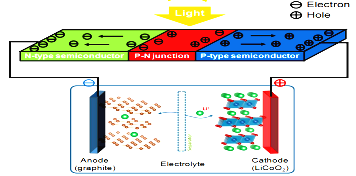
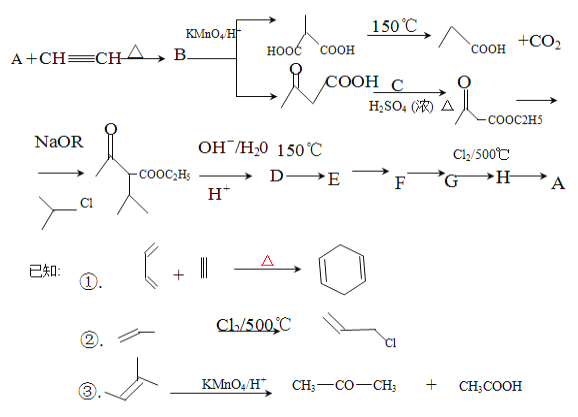
题目内容
【题目】A、B、C、D是中学化学中的常见物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如图所示(反应中的其他产物已略去)。请填空:
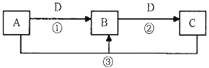
(1)若B是常见的两性氢氧化物
①若D是强酸,则能确定A中肯定含的离子的化学式是________。
②若D是强碱,则反应②的离子方程式是___________________________。
(2)若A是一种能使湿润的红色石蕊试纸变蓝的气体;B是汽车尾气之一,遇空气会变色;则反应①的化学方程式为_________________。
(3)若A、B、C的的焰色反应都呈黄色,D是一种无色无味的气态酸性氧化物,则反应③的离子方程式是_____________________________。
(4)若D是生产、生活中用量最大、用途最广的金属单质
①若A可用于自来水消毒,则用A制备漂白粉的化学方程式是_____________________。
②若A是某强酸的稀溶液,则A的化学式可能是_________。
【答案】AlO2- Al(OH)3+OH-=AlO2-+2H2O 4NH3+5O2![]() 4NO+6H2O OH-+HCO3-=H2O+CO32- 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O HNO3
4NO+6H2O OH-+HCO3-=H2O+CO32- 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O HNO3
【解析】
(1)若B是常见的两性氢氧化物;
①若D是强酸,B为两性氢氧化物为Al(OH)3,则能确定A中肯定含的离子的化学式是:AlO2-;
②若D是强碱,B为两性氢氧化物为Al(OH)3,A为Al3+,反应②是氢氧化铝和强碱反应;
(2) 若A是一种能使湿润的红色石蕊试纸变蓝的气体,判断A为碱性气体为NH3,B是汽车尾气之一,遇空气会变色,证明D为O2,反应①是氨气的催化氧化反应生成一氧化氮和水;
(3)若A、B、C的焰色反应都呈黄色,证明含有钠元素,D是一种无色无味的气态酸性氧化物,则D是CO2;
(4)若D是生产、生活中用量最大、用途最广的金属单质判断为Fe;
①若A可用于自来水消毒,证明为Cl2,则用A制备漂白粉的化学方程式是氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,
②若A是某强酸的稀溶液,实现上述转化必须要求酸是氧化性酸,判断为HNO3。
(1)若B是常见的两性氢氧化物;
①若D是强酸,B为两性氢氧化物为Al(OH)3,则能确定A中肯定含的离子的化学式是:AlO2-;
因此,本题正确答案是:AlO2-;
②若D是强碱,B为两性氢氧化物为Al(OH)3,A为Al3+反应②是氢氧化铝和强碱反应,反应的离子方程式是:Al(OH)3+OH-=AlO2-+2H2O,
因此,本题正确答案是:Al(OH)3+OH-=AlO2-+2H2O;
(2) 若A是一种能使湿润的红色石蕊试纸变蓝的气体,判断A为碱性气体为NH3,B是汽车尾气之一,遇空气会变色,证明D为O2,反应①是氨气的催化氧化反应生成一氧化氮和水;
化学方程式为:4NH3+5O2![]() 4NO+6H2O,
4NO+6H2O,
因此,本题正确答案是:4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(3)若A、B、C的焰色反应都呈黄色,证明含有钠元素,D是一种无色无味的气态酸性氧化物,则D是CO2,反应③为氢氧化钠与碳酸氢钠溶液反应生成碳酸钠和水,离子方程式是OH-+HCO3-=H2O+CO32-,
因此,本题正确答案是:OH-+HCO3-=H2O+CO32-;
(4)若D是生产、生活中用量最大、用途最广的金属单质判断为Fe;
①若A可用于自来水消毒,证明为Cl2,则用A制备漂白粉的化学方程式是氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,反应的化学方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
因此,本题正确答案是:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
②若A是某强酸的稀溶液,实现上述转化必须要求酸是氧化性酸,判断为HNO3,
因此,本题正确答案是:HNO3。

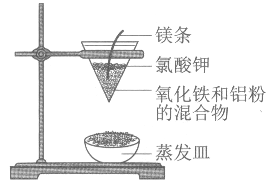
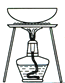
【题目】完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是
选项 | A | B | C | D |
实验 | 用CCl4提取溴水中的Br2 | 除去乙醇中的苯 | 从KI和I2的固体混合物中回收I2 | 配制100 mL 0.1000mol·L1 K2Cr2O7溶液 |
装置或仪器 |
|
|
|
|
A. AB. BC. CD. D