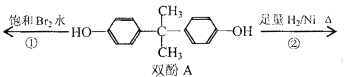
题目内容
【题目】有6种短周期元素,原子序数按E、D、B、A、F、C的顺序依次增大;A、C同周期,B、C同主族;A与B可形成离子化合物A2B,且离子的电子数均相同;D和E可形成4核10电子的分子;F是第三周期元素的简单离子中半径最小的。试回答下列问题(用相应的元素符号表示):
(1)写出B在元素周期表中的位置: _______________;C的原子结构示意图为_______________。
(2)B与E形成的化合物E2B2的电子式为__________;D和E形成4核10电子的分子的结构式为__________;A、B、E形成的化合物中存在的化学键____________________。
(3)元素A与元素F相比,金属性较弱的是________(用元素符号表示),写出实验室制备其最高价氧化物的水化物反应的离子方程式为____________________________________________。
(4)常压下1.6gC的单质在足量的空气中完全燃烧放出14.85kJ的热量,写出表示其燃烧热的热化学方程式_______________________________________ 。
【答案】 第二周期第ⅥA族 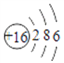
![]()
![]() 离子键和极性共价键 Al Al3++3NH3H2O=Al(OH)3↓+3NH4+ S(s)+O2(g)=SO2(g) △H=-297kJ/mol
离子键和极性共价键 Al Al3++3NH3H2O=Al(OH)3↓+3NH4+ S(s)+O2(g)=SO2(g) △H=-297kJ/mol
【解析】分析:有6种短周期元素,原子序数按E、D、B、A、F、C的顺序依次增大;A、C同周期,B、C同主族;A与B可形成离子化合物A2B,且离子的电子数均相同,因此该化合物是氧化钠,则A是Na,B是O,所以C是S;D和E可形成4核10电子的分子是NH3,所以E是H,D是N;F是第三周期元素的简单离子中半径最小的,F是Al。
详解:根据以上分析可知A、B、C、D、E、F分别是Na、O、S、N、H、Al。则
(1)氧元素在元素周期表中的位置是第二周期第ⅥA族;硫的原子序数是16,其原子结构示意图为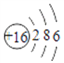 。
。
(2)B与E形成的化合物E2B2是双氧水,含有极性键和非极性键,电子式为![]() ;D和E形成4核10电子的分子是氨气,结构式为
;D和E形成4核10电子的分子是氨气,结构式为![]() ;A、B、E形成的化合物是氢氧化钠,其中存在的化学键为离子键和极性共价键。
;A、B、E形成的化合物是氢氧化钠,其中存在的化学键为离子键和极性共价键。
(3)同周期自左向右金属性逐渐增强,则元素A与元素F相比,金属性较弱的是Al。由于氢氧化铝是两性氢氧化物,则实验室制备氢氧化铝的离子方程式为Al3++3NH3H2O=Al(OH) 3↓+3NH4+。
(4)常压下1.6gC的单质是1.6g÷32g/mol=0.05mol,在足量的空气中完全燃烧放出14.85kJ的热量,则1mol硫完全燃烧放出的热量是![]() ,所以表示其燃烧热的热化学方程式为S(s)+O2(g)=SO2(g) △H=-297kJ/mol。
,所以表示其燃烧热的热化学方程式为S(s)+O2(g)=SO2(g) △H=-297kJ/mol。

 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示,这四种元素的原子最外层电子数之和是24,下列说法中正确的是( )
X | Y | |
Z | W |
A. 原子半径:![]()
B. 最高价氧化物对应水化物的酸性:![]()
C. 四种元素的单质中,W单质的熔、沸点最高
D. X的气态氢化物可与它的最高价氧化物的水化物发生反应