��Ŀ����
����Ŀ����1����MnSO4������Ļ����Һ�����K2S2O8(���������)����Һ�лᷢ�����·�Ӧ��Mn2++ S2O82-+H2O��MnO4-+SO42һʮH+�÷�Ӧ�����ڼ���Mn2+�Ĵ��ڡ�������������_____________������Ӧ����0��1 mol��ԭ���μӷ�Ӧ�������������������ʵ���Ϊ____________mol��
��2�����÷�Ӧ���õ������̸�Ϊ�Ȼ��̣������������Ĺ�������ط�Ӧʱ�����и�����ء�����ء����������⣬�����������ﻹ��___________________��
��3����NaBiO3����(��ɫ��)���뵽MnSO4��H2SO4�Ļ����Һ����ȣ������ܽ��Ϊ������Һ���������·�Ӧ��
___NaBiO3+ MnSO4+ H2S04�� Na2S04+ Bi2(SO4)3+ NaMnO4+ H2O��
����ƽ������Ӧ�Ļ�ѧ����ʽ��
��������Ӧ�л�ԭ������_______________��
���õ����ű�ʾ��������ԭ��Ӧת�Ƶ������:_______________________________________________________________________��
���𰸡� ��Һ����ɫ��Ϊ��ɫ 0.25 Cl2 10 NaBiO3+ 4 MnSO4+ 14 H2S04�� 3Na2S04+ 5 Bi2(SO4)3+ 4 NaMnO4+ 14 H2O�� Bi2(SO4)3 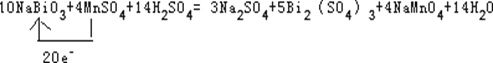
�������������������1�����ڷ�Ӧ���ɸ���������ӣ���Һ����ɫ��Ϊ��ɫ����Ӧ������������ԭ������Ԫ�ػ��ϼ�����5�ۣ���Ԫ�ػ��ϼ۽���1�ۣ����Ի�ԭ�����������ı���Ϊ2:5�����Ե���0.1Ħ����ԭ����Ӧ������������Ϊ0.25Ħ���� ��2����Ϊ��������������Դ������������Է�Ӧ�л���Cl2���ɡ���3�� ��������Ԫ�ػ��ϼ۴�+5���͵�+3������2�ۣ���Ԫ�ػ��ϼ۴�+2���ߵ�+7������5�ۣ������������ͻ�ԭ���ı���Ϊ5:2���ٸ���ԭ���غ���ƽ����ϵ��Ϊ10��4��14��3��5��4��14������Ԫ�ػ��ϼ۽��ͣ����Ի�ԭ����ΪBi2(SO4)3��
��������ƽ���̷�����Ԫ�صõ�20�����ӣ���Ԫ��ʧȥ20�����ӣ����Ե�����Ϊ
![]()

����Ŀ������������ɽ����ѧ2017��������Ĵ�ģ�⿼�ԡ���������ʵ�ó��Ľ�����ȷ����
�� ʵ | �� �� | |
A | HClO��H2SO3��Ӧ����H2SO4��HCl | �ǽ����ԣ�Cl>S |
B | N2�Ȱ����ȶ��ö� | �ǽ����ԣ�N<P |
C | ��Լ800��ʱ�������ƿɴ����ڵ�KCl���û���K | �����ԣ�Na>K |
D | ��ҵ�ϵ��Na3AlF6��Al2O3�����ڻ����õ�Al | ������ԣ�Na>Al |