题目内容
mA(气) + nB(气) pC(气) + qQ(气)当m、n、p、q为任意整数时,下列情况一定是平衡状态的是:
pC(气) + qQ(气)当m、n、p、q为任意整数时,下列情况一定是平衡状态的是:
体系的压强不再改变
体系的温度不再改变
各组分的浓度不再改变
各组分的质量分数不再改变
反应速率Va:Vb:Vc:Vd=m:n:p:q
单位时间内m mol A断键反应,同时p mol C也断键反应
| A.③④⑤⑥ | B.②③④⑥ | C.①③④⑤ | D.①③④⑥ |
B
解析试题分析:①若反应前后气体的体积发生不变,体系的压强不再改变说明到达平衡,若反应前后气体的物质的量不变,体系的压强自始至终不变,体系的压强不再改变不能说明到达平衡,故①错误;②随反应进行体系的温度发生变化,绝热体系的温度不再改变说明到达平衡,故②正确; ③随反应进行各组分的浓度发生不变,各组分的浓度不再改变说明到达平衡,故③正确;④随反应进行各组分的质量分数发生不变,各组分的质量分数不再改变说明到达平衡,故④正确;⑤反应速率自始至终都按vA:vB:vC:vD=m:n:p:q,不能说明到达平衡,故⑤错误;⑥A断键表示正反应速率,C断键表示逆反应速率,单位时间内m molA断键反应,同时生成pmolC,C的断键与成键相等,说明到达平衡,故⑥正确。
考点:化学平衡状态的判断

下列对化学平衡移动的分析中,不正确的是
①已达平衡的反应C(s)+H2O(g) CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g) 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③有气体参加的反应平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
| A.①④ | B.①②③ | C.②③④ | D.①②③④ |
某可逆反应平衡常数表达式为K=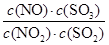 。达到平衡状态时,如果升高温度(其它条件不变),则K值减小。下列说法正确的是( )
。达到平衡状态时,如果升高温度(其它条件不变),则K值减小。下列说法正确的是( )
A.反应的热化学方程式为NO2(g)+SO2(g)  NO(g)+SO3(g) ΔH>0 NO(g)+SO3(g) ΔH>0 |
| B.混合气体的平均摩尔质量保持不变,说明反应已达平衡 |
| C.一定条件下达到平衡时,缩小容器体积,增大体系压强,气体颜色加深 |
| D.使用合适的催化剂可使该反应的反应速率和平衡常数增大 |
可逆反应2SO2 + O2 2SO3达到一定限度后通入18O2,一段时间18O可能存在于( )
2SO3达到一定限度后通入18O2,一段时间18O可能存在于( )
| A.SO3和O2 中 | B.SO3和SO2 中 |
| C.SO3, SO2和O2 中 | D.SO2和O2 中 |
T℃时,将6 mol CO2和8 mol H2充入2L密闭容器中,发生反应CO2 ( g ) + 3 H2 ( g )  CH3 OH ( g )+H2O( g),容器中H2的物质的量随时间变化如图中实线所示。图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化。则下列说法正确的是
CH3 OH ( g )+H2O( g),容器中H2的物质的量随时间变化如图中实线所示。图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化。则下列说法正确的是
| A.反应开始至a点时υ(H2) ="1" mol·L-1·min-1 |
| B.曲线II对应的条件改变是降低压强 |
| C.若曲线I对应的条件改变是升温,则该反应△H >0 |
| D.T℃时,该反应的化学平衡常数为0.125 |
可逆反应①X(g)+2Y(g)  2Z(g)、②2M(g)
2Z(g)、②2M(g)  N(g)+P(g)分别在密闭容器的两个反应室中进行, 反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
N(g)+P(g)分别在密闭容器的两个反应室中进行, 反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示: 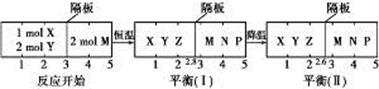
下列判断正确的是( )
| A.在平衡(Ⅰ)和平衡(Ⅱ)中, M的体积分数相等 |
B.达平衡(Ⅰ)时, X的转化率为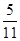 |
| C.达平衡(Ⅰ)时体系的压强与反应开始时体系的压强之比为14∶15 |
| D.反应①的正反应是吸热反应 |
 pC(g)+qD(g) △H<0。下列结论中错误的是( )
pC(g)+qD(g) △H<0。下列结论中错误的是( ) 2C(g)一段时间后达到平衡,生成n mol C。则下列说法中不正确的是( )
2C(g)一段时间后达到平衡,生成n mol C。则下列说法中不正确的是( ) )
) 2NH3,今有A、B、C、D四个容器,每个容器中有两种操作,两种操作分别达到平衡后,操作1中N2和操作2中NH3转化率之和一定不为1的是(起始体积相同)
2NH3,今有A、B、C、D四个容器,每个容器中有两种操作,两种操作分别达到平衡后,操作1中N2和操作2中NH3转化率之和一定不为1的是(起始体积相同)