题目内容
14.(1)在标准状况下1.7g氨气所占的体积为2.24L,它与同条件下0.15molH2S含有相同的氢原子.(2)某气体物质质量为6.4g,含有6.02×1022个分子,则该气体的摩尔质量为64g/mol.
(3)100mL、0.5mol/L的(NH4)2SO4溶液中含有NH${\;}_{4}^{+}$0.1mol,这些NH${\;}_{4}^{+}$中所含有的电子的物质的量为1mol,质子的物质的量为1.1mol.
分析 (1)根据n=$\frac{m}{M}$计算氨气物质的量,根据V=nVm计算氨气体积,结合含有氢原子数目相等计算硫化氢物质的量;
(2)根据n=$\frac{N}{{N}_{A}}$计算气体物质的量,再根据M=$\frac{m}{n}$气体摩尔质量;
(3)根据n=cV计算铵根离子物质的量,每个NH4+含有10个电子、11个质子.
解答 解:(1)氨气物质的量为$\frac{1.7g}{17g/mol}$=0.1mol,标况下氨气体积为0.1mol×22.4L/mol=2.24L,与之含有氢原子数目相等的硫化氢物质的量为$\frac{0.1mol×3}{2}$=0.15mol,
故答案为:2.24L;0.15;
(2)气体物质的量为$\frac{6.02×1{0}^{22}}{6.02×1{0}^{23}mo{l}^{-1}}$=0.1mol,该气体摩尔质量为$\frac{6.4g}{0.1mol}$=64g/mol,
故答案为:64g/mol;
(3)铵根离子物质的量为0.1L×0.5mol/L×2=0.1mol,每个NH4+含有10个电子、11个质子,则含有电子为0.1mol×10=1mol,含有质子为0.1mol×11=1.1mol,
故答案为:0.1;1mol;1.1mol.
点评 本题考查物质的量计算,比较基础,注意掌握以物质的量为中心的计算,有利于基础知识的巩固.

练习册系列答案
相关题目
4.现有下列四个图象:

下列反应中全部符合上述图象的反应是( )

下列反应中全部符合上述图象的反应是( )
| A. | N2(g)+3H2(g)?2NH3(g)△H1<0 | B. | 2SO3(g)?2SO2(g)+O2(g)△H2>0 | ||
| C. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H3<0 | D. | H2(g)+CO(g)?C(s)+H2O(g)△H4>0 |
2.将等物质的量浓度、等体积的Ba(OH)2溶液与盐酸混合后,滴入紫色石蕊试液,溶液呈( )
| A. | 紫色 | B. | 红色 | C. | 蓝色 | D. | 无色 |
6.下列化学用语表示正确的是( )
| A. | 氮气的结构式:N≡N | |
| B. | Cl-的结构示意图: | |
| C. | 水的电子式: | |
| D. | 磷酸钠的电离方程式:Na3PO4=Na33++PO43- |
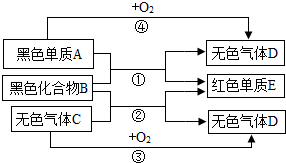

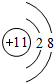 .
. 3,3,5,5-四甲基庚烷;
3,3,5,5-四甲基庚烷; ;
;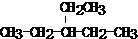 .
.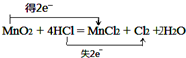 .
.