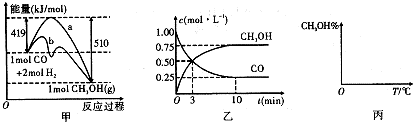
题目内容
通常状况下,甲烷的性质 ,与强氧化剂如 、强酸、强碱等均 发生化学反应.
(1)燃烧(氧化反应):甲烷燃烧时,火焰呈 ,反应的化学方程为 .
(2)取代反应 教材科学探究的实验现象:
① .
② .
③ .
在光照的条件下,甲烷和氯气发生反应的化学方程式为:
① ;
② ;
③ ;
④ .
四种氯代产物中, 为气体, 、 、 为液体,且它们均 溶于水.
取代反应的定义: .
(3)甲烷的裂解: .
(1)燃烧(氧化反应):甲烷燃烧时,火焰呈
(2)取代反应 教材科学探究的实验现象:
①
②
③
在光照的条件下,甲烷和氯气发生反应的化学方程式为:
①
②
③
④
四种氯代产物中,
取代反应的定义:
(3)甲烷的裂解:
考点:甲烷的化学性质,甲烷的取代反应
专题:有机物的化学性质及推断
分析:依据甲烷为饱和烃,结构稳定分析解答;
(1)甲烷只含碳和氢两种元素,且含氢量很高,在氧气中燃烧生成二氧化碳和水;
(2)氯气与甲烷在光照条件下发生取代反应,生成一氯甲烷、二氯甲烷、三氯甲烷、四氯化碳和氯化氢,二氯甲烷、三氯甲烷、四氯化碳常温下为油状液体,不溶于水,反应过程中消耗氯气,使得量筒内压强减小,据此解答;
甲烷与氯气逐步发生取代反应依次生成一氯甲烷、二氯甲烷、三氯甲烷、四氯化碳;
(3)甲烷在高温条件下裂解生成碳和氢气.
(1)甲烷只含碳和氢两种元素,且含氢量很高,在氧气中燃烧生成二氧化碳和水;
(2)氯气与甲烷在光照条件下发生取代反应,生成一氯甲烷、二氯甲烷、三氯甲烷、四氯化碳和氯化氢,二氯甲烷、三氯甲烷、四氯化碳常温下为油状液体,不溶于水,反应过程中消耗氯气,使得量筒内压强减小,据此解答;
甲烷与氯气逐步发生取代反应依次生成一氯甲烷、二氯甲烷、三氯甲烷、四氯化碳;
(3)甲烷在高温条件下裂解生成碳和氢气.
解答:
解:甲烷为饱和烃,结构稳定,不能被酸性的高锰酸钾氧化,不与强酸、强碱发生反应;
故答案为:稳定;酸性的高锰酸钾;不;
(1)甲烷含有碳和氢两种元素,在空气中能够燃烧,发出淡蓝色的火焰,生成二氧化碳和水,反应的方程式为:CH4+2O2
CO2+2H2O;
故答案为:淡蓝色;CH4+2O2
CO2+2H2O;
(2)氯气与甲烷在光照条件下发生取代反应,生成一氯甲烷、二氯甲烷、三氯甲烷、四氯化碳和氯化氢,二氯甲烷、三氯甲烷、四氯化碳常温下为油状液体,不溶于水,反应过程中消耗氯气,使得量筒内压强减小,看到的现象为:试管内的黄绿色消失;试管壁上有油状液体;试管内液面上升;
故答案为:①试管内的黄绿色消失;
②试管壁上有油状液体;
③试管内液面上升;
在光照的条件下,甲烷与氯气逐步发生取代反应依次生成一氯甲烷、二氯甲烷、三氯甲烷、四氯化碳,反应的方程式分别为:
①CH4+Cl2
CH3Cl+HCl;
②CH3Cl+Cl2
CH2Cl2+HCl;
③CH2Cl2+Cl2
CH3Cl3+HCl;
④CH3Cl3++Cl2
CCl4+HCl;
故答案为:①CH4+Cl2
CH3Cl+HCl;
②CH3Cl+Cl2
CH2Cl2+HCl;
③CH2Cl2+Cl2
CH3Cl3+HCl;
④CH3Cl3++Cl2
CCl4+HCl;
一氯甲烷为气体,二氯甲烷、三氯甲烷、四氯化碳常温下为油状液体,依据相似相溶原理,均不溶于水;
取代反应是指:有机化合物分子中任何一个原子或基团被试剂中同类型的其它原子或基团所取代的反应;
故答案为:一氯甲烷;二氯甲烷、三氯甲烷、四氯化碳;
有机化合物分子中任何一个原子或基团被试剂中同类型的其它原子或基团所取代的反应;
(3)甲烷在高温条件下裂解生成碳和氢气,反应的方程式为:CH4(g)?C(s)+2H2(g),
故答案为:CH4(g)?C(s)+2H2(g).
故答案为:稳定;酸性的高锰酸钾;不;
(1)甲烷含有碳和氢两种元素,在空气中能够燃烧,发出淡蓝色的火焰,生成二氧化碳和水,反应的方程式为:CH4+2O2
| ||
故答案为:淡蓝色;CH4+2O2
| ||
(2)氯气与甲烷在光照条件下发生取代反应,生成一氯甲烷、二氯甲烷、三氯甲烷、四氯化碳和氯化氢,二氯甲烷、三氯甲烷、四氯化碳常温下为油状液体,不溶于水,反应过程中消耗氯气,使得量筒内压强减小,看到的现象为:试管内的黄绿色消失;试管壁上有油状液体;试管内液面上升;
故答案为:①试管内的黄绿色消失;
②试管壁上有油状液体;
③试管内液面上升;
在光照的条件下,甲烷与氯气逐步发生取代反应依次生成一氯甲烷、二氯甲烷、三氯甲烷、四氯化碳,反应的方程式分别为:
①CH4+Cl2
| 光照 |
②CH3Cl+Cl2
| 光照 |
③CH2Cl2+Cl2
| 光照 |
④CH3Cl3++Cl2
| 光照 |
故答案为:①CH4+Cl2
| 光照 |
②CH3Cl+Cl2
| 光照 |
③CH2Cl2+Cl2
| 光照 |
④CH3Cl3++Cl2
| 光照 |
一氯甲烷为气体,二氯甲烷、三氯甲烷、四氯化碳常温下为油状液体,依据相似相溶原理,均不溶于水;
取代反应是指:有机化合物分子中任何一个原子或基团被试剂中同类型的其它原子或基团所取代的反应;
故答案为:一氯甲烷;二氯甲烷、三氯甲烷、四氯化碳;
有机化合物分子中任何一个原子或基团被试剂中同类型的其它原子或基团所取代的反应;
(3)甲烷在高温条件下裂解生成碳和氢气,反应的方程式为:CH4(g)?C(s)+2H2(g),
故答案为:CH4(g)?C(s)+2H2(g).
点评:本题考查了甲烷的性质和结构,题目侧重考查课本基础知识,难度不大,依据所学知识不难解答.

练习册系列答案
相关题目
 一根细如发丝的光缆可以同时传导上千部电话,是铜导线传导能力的约100倍左右.“光缆无铜,盗割有罪”.试问:光缆主要是以
一根细如发丝的光缆可以同时传导上千部电话,是铜导线传导能力的约100倍左右.“光缆无铜,盗割有罪”.试问:光缆主要是以能证明乙醇分子中有一个羟基的是( )
| A、乙醇完全燃烧生成CO2和H2O |
| B、乙醇能与水以任意比混溶 |
| C、0.1 mol乙醇与足量钠反应只能生成0.1 g氢气 |
| D、乙醇在铜催化下可被氧化 |
下列变化是物理变化的是( )
| A、将金属钠和金属钾混合研磨得到液体 |
| B、刚切开的金属钠放置在空气中变暗 |
| C、刚切开的金属钠放置在空气中加热变成淡黄色 |
| D、一小块钠投入到水中熔成闪亮的小球 |
下列叙述正确的是( )
| A、Fe分别与氯气和稀盐酸反应所得氯化物相同 |
| B、某无色溶液中通入Cl2,溶液变为淡黄色,再加入淀粉溶液,溶液变为蓝色,说明原溶液中存在I- |
| C、CO2、NO2、SO2都能与H2O反应,其反应原理相同 |
| D、C、N、S三种单质直接与02反应都能生成两种氧化物 |