题目内容
【题目】830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g)CO2(g)+H2(g)△H<0,若起始时c(CO)=2molL﹣1 , c(H2O)=3molL﹣1 , 达到平衡时CO的转化率为60%,则在此温度下,该反应的平衡常数K= .
【答案】1
【解析】解:(1)平衡时CO的转化率为60%,则CO的浓度变化量=2mol/L×60%=1.2mol/L,则:
CO(g)+ | H2O(g) | CO2(g)+ | H2(g) | ||
起始(mol/L): | 2 | 3 | |||
变化(mol/L): | 1.2 | 1.2 | 1.2 | 1.2 | |
平衡(mol/L): | 0.8 | 1.8 | 1.2 | 1.2 |
故平衡常数K= ![]() =1
=1
所以答案是:1.
【考点精析】解答此题的关键在于理解化学平衡的计算的相关知识,掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.

【题目】已知:反应①Fe(s)+CO2(g)FeO(s)+CO(g);△H=Q1 , 平衡常数为K1 , 反应②Fe(s)+H2O(g)FeO(s)+H2(g);△H=Q2 , 平衡常数为K2 ,
在不同温度下,K1、K2的值如下:
T(K) | K1 | K2 |
700 | 1.47 | 2.38 |
900 | 2.15 | 1.67 |
(1)从上表可推断,反应Q10(填“>”或“<”).
(2)现有反应③H2(g)+CO2(g)CO(g)+H2O(g);△H=Q3平衡常数为K3 . 根据反应①与②推导出K1、K2、K3的关系式K3= , Q1、Q2、Q3的关系式Q3= , 可推断反应③是(填“放”或“吸”)热反应.
(3)要使反应③在一定条件下建立的平衡右移,可采取的措施有 .
A.缩小容器体积
B.扩大容器的体积
C.降低温度E.升高温度
D.使用合适的催化剂
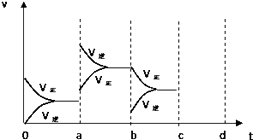
(4)如图甲、乙表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况: 图甲中t2时刻改变的条件可能是 , 图乙中t2时刻改变的条件可能是 . 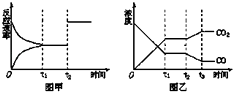
【题目】在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅.
时间(s) | 0 | 20 | 40 | 60 | 80 | 100 |
C(N2O4) | 0.20 | a | 0.10 | c | d | e |
C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
(1)该反应的化学方程式为 , 表中bc(填“<”、“=”、“>”).
(2)20s时,N2O4的浓度为mol/L,0~20s内N2O4的平均反应速率为 .
(3)该反应的平衡常数表达式K= , 在80℃时该反应的平衡常数K值为(保留2位小数).
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时 . A、N2O4的转化率越高 B、NO2的产量越大
C、N2O4与NO2的浓度之比越大 D、正反应进行的程度越大.