题目内容
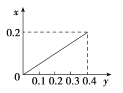
【题目】将一定量的镁铝合金投入100 mL一定浓度的盐酸中,合金即溶解。向所得溶液中滴加5 mol/L NaOH溶液,生成沉淀的质量与加入的NaOH溶液的体积如图所示,由图中数据分析计算:

(1)原合金中镁和铝的质量分别为多少?
(2)盐酸的物质的量浓度为多少?
【答案】(1)mMg=4.8g mAl=2.7g;(2)cHCl=8mol/L
【解析】
合金全部溶解,溶液中一定有Al3+和Mg2+,而H+可能含有;由图可知,加入NaOH溶液体积若小于20mL,溶液中没有沉淀出现,所以反应后的溶液中仍然剩余H+,所以从V(NaOH)=0mL至V(NaOH)=20mL,发生的是酸碱中和反应;V(NaOH)=20mL至V(NaOH)=160mL,则发生的是Al3+和Mg2+的沉淀反应;V(NaOH)=160mL时,溶液中的Al3+和Mg2+恰好沉淀完全,那么此时溶液中的溶质仅为NaCl,根据加入的NaOH的量即可最终求得盐酸的浓度;V(NaOH)=160mL至V(NaOH)=180mL,沉淀量在减少,所以发生的是Al(OH)3的溶解反应即:![]() ,由此可计算合金中Al的量,再结合V(NaOH)=20mL至V(NaOH)=160mL总共消耗的NaOH的量,就可间接求出合金中Mg的量。
,由此可计算合金中Al的量,再结合V(NaOH)=20mL至V(NaOH)=160mL总共消耗的NaOH的量,就可间接求出合金中Mg的量。
(1) 通过分析可知,V(NaOH)=160mL至V(NaOH)=180mL,发生Al(OH)3的溶解反应即:![]() ,所以合金中铝的质量为:
,所以合金中铝的质量为:![]() ;通过分析可知,V(NaOH)=20mL至V(NaOH)=160mL,发生的是Al3+和Mg2+的沉淀反应,Al3+的量为0.1mol需要消耗0.3molOH-,所以合金中镁的质量为:
;通过分析可知,V(NaOH)=20mL至V(NaOH)=160mL,发生的是Al3+和Mg2+的沉淀反应,Al3+的量为0.1mol需要消耗0.3molOH-,所以合金中镁的质量为:![]() ;
;
(2)通过分析可知,加入的NaOH体积为160mL时,溶液中的溶质仅为NaCl,所以原来盐酸的浓度为:![]() 。
。

【题目】某小组利用H2C2O4溶液和硫酸酸化的KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时通过测定酸性KMnO4溶液褪色所需时间来判断反应的快慢。该小组设计了如下方案。已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
实验编号 | 0.1mol/L酸性KMnO4溶液的体积/mL | 0.6mol/LH2C2O4溶液的体积/mL | H2O的体积/mL | 实验温度/℃ | 溶液褪色所需时间/min |
① | 10 | V1 | 35 | 25 | |
② | 10 | 10 | 30 | 25 | |
③ | 10 | 10 | V2 | 50 |
(1)表中V1=_______mL,V2=_______mL。
(2)探究温度对化学反应速率影响的实验编号是________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是________。
(3)实验①测得KMnO4溶液的褪色时间为2min,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(H2C2O4)=________mol·L-1·min-1。