题目内容
表中列出了①~⑥六种元素在周期表中的位置:
请按要求回答下列问题.
(1)元素①的元素符号是
(2)元素②的气态氢化物化学式是
 .
.
(3)元素⑤的原子结构示意图是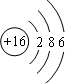
 ,最高价氧化物的化学式是
,最高价氧化物的化学式是
(4)这六种元素中,位于第三周期且原子半径最小的是(填元素符号)
(5)这六种元素的最高价氧化物中,属于两性氧化物的是(填化学式)
(6)在盛有水的小烧杯中加入元素③的单质,发生反应的化学方程式为:
族 周期 |
ⅠA | 0 | ||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ||||
(1)元素①的元素符号是
C
C
.(2)元素②的气态氢化物化学式是
NH3
NH3
,电子式是

(3)元素⑤的原子结构示意图是


SO3
SO3
.(4)这六种元素中,位于第三周期且原子半径最小的是(填元素符号)
Cl
Cl
.(5)这六种元素的最高价氧化物中,属于两性氧化物的是(填化学式)
Al2O3
Al2O3
.(6)在盛有水的小烧杯中加入元素③的单质,发生反应的化学方程式为:
2Na+2H2O═2NaOH+H2↑
2Na+2H2O═2NaOH+H2↑
.分析:(1)根据周期数和族序数确定元素名称和符号;
(2)元素确定,结合化合价来书写氢化物的化学式,氨气是共价化合物,分子中含有三个氮氢共价键;
(3)根据原子核外电子排布的规律来书写原子结构示意图,元素的最高化合价=元素的最外层电子数;
(4)同周期元素的原子,从左到右,原子半径逐渐减小;
(5)中学阶段所学的两性氧化物为氧化铝;
(6)金属钠能和水反应生成氢氧化钠和氢气.
(2)元素确定,结合化合价来书写氢化物的化学式,氨气是共价化合物,分子中含有三个氮氢共价键;
(3)根据原子核外电子排布的规律来书写原子结构示意图,元素的最高化合价=元素的最外层电子数;
(4)同周期元素的原子,从左到右,原子半径逐渐减小;
(5)中学阶段所学的两性氧化物为氧化铝;
(6)金属钠能和水反应生成氢氧化钠和氢气.
解答:解:(1)根据表中元素在周期表中的位置,可知①是C,故答案为:C;
(2)第二周期第ⅤA的元素是N,其氢化物的化学式为NH3,氨气是共价化合物,分子中含有三个氮氢共价键,电子式为: ,故答案为:
,故答案为: ;
;
(3)第三周期第ⅤⅠA的元素是S,原子核外电子排布示意图为: ,元素的最高化合价=元素的最外层电子数=6,所以最高价氧化物是SO3,故答案为:
,元素的最高化合价=元素的最外层电子数=6,所以最高价氧化物是SO3,故答案为: ;SO3;
;SO3;
(4)第三周期元素的原子,从左到右,原子半径逐渐减小,所以半径最小的是Cl,故答案为:Cl;
(5)氧化铝是两性氧化物,故答案为:Al2O3;
(6)元素③位于第三周期第ⅠA族,是金属钠,金属钠能和水反应生成氢氧化钠和氢气,2Na+2H2O═2NaOH+H2↑
故答案为:2Na+2H2O═2NaOH+H2↑.
(2)第二周期第ⅤA的元素是N,其氢化物的化学式为NH3,氨气是共价化合物,分子中含有三个氮氢共价键,电子式为:
 ,故答案为:
,故答案为: ;
;(3)第三周期第ⅤⅠA的元素是S,原子核外电子排布示意图为:
 ,元素的最高化合价=元素的最外层电子数=6,所以最高价氧化物是SO3,故答案为:
,元素的最高化合价=元素的最外层电子数=6,所以最高价氧化物是SO3,故答案为: ;SO3;
;SO3;(4)第三周期元素的原子,从左到右,原子半径逐渐减小,所以半径最小的是Cl,故答案为:Cl;
(5)氧化铝是两性氧化物,故答案为:Al2O3;
(6)元素③位于第三周期第ⅠA族,是金属钠,金属钠能和水反应生成氢氧化钠和氢气,2Na+2H2O═2NaOH+H2↑
故答案为:2Na+2H2O═2NaOH+H2↑.
点评:本题考查学生元素周期表的结构和元素周期律的有关知识,可以根据所学知识来回答,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
表中列出了①~⑥六种元素在周期表中的位置:
请按要求回答下列问题.
(1)元素①的元素符号是 .
(2)元素②的气态氢化物化学式是 ,电子式是 .
(3)元素⑤的原子结构示意图是 ,最高价氧化物的化学式是 .
(4)这六种元素中,位于第三周期且原子半径最小的是(填元素符号) .
(5)这六种元素的最高价氧化物中,属于两性氧化物的是(填化学式) .
(6)在盛有水的小烧杯中加入元素③的单质,发生反应的化学方程式为: .
族 周期 | ⅠA | |||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ||||
(1)元素①的元素符号是 .
(2)元素②的气态氢化物化学式是 ,电子式是 .
(3)元素⑤的原子结构示意图是 ,最高价氧化物的化学式是 .
(4)这六种元素中,位于第三周期且原子半径最小的是(填元素符号) .
(5)这六种元素的最高价氧化物中,属于两性氧化物的是(填化学式) .
(6)在盛有水的小烧杯中加入元素③的单质,发生反应的化学方程式为: .
 有A、B、C、D、E、F六种元素,已知:它们位于三个不同短周期,核电荷数依次增大;A与E、B与F分别同主族;A、E分别都能与D按原子个数比1﹕1或2﹕l形成化合物;B、C分别都能与D按原子个数比1﹕1或1﹕2形成化合物.
有A、B、C、D、E、F六种元素,已知:它们位于三个不同短周期,核电荷数依次增大;A与E、B与F分别同主族;A、E分别都能与D按原子个数比1﹕1或2﹕l形成化合物;B、C分别都能与D按原子个数比1﹕1或1﹕2形成化合物.