题目内容
请你参与下列探究:[问题情景]某化学实验小组同学将铁粉投入硫酸铜溶液中,发现生成红色固体物质的同时有较多的气泡放出.同学们都能解释红色固体物质的出现,请你写出生成红色固体物质的化学反应方程式
[提出猜想]从物质组成元素的角度,放出的气体可能是02.S02.H2.
[查阅资料]SO2易溶于水,它能与过量的NaOH溶液反应,生成Na2SO3.
[方案设计]依据上述猜想,实验小组同学分别设计了如下方案:
(1)甲同学认为是02,则较简单的检验方法是
(2)乙同学认为是SO2,则只需将放出的气体通入盛有NaOH溶液的洗气瓶中,称量通气前后洗气瓶的质量.写出SO2与过量的NaOH溶液反应的化学方程式
(3)甲、乙同学的实验结果表明气体中既不含02也不含SO2,丙同学根据以上实验结果推测气体是H2.
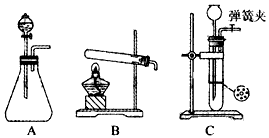
[实验探究]丙同学为了检验H2,收集了一试管气体,用拇指堵住试管口且管口略向下倾斜靠近火焰移开拇指点火,听到很小的声音.然后再将气体用带尖嘴的导管导出点燃且用冷而干燥的烧杯罩在火焰的上方,气体在空气里安静的燃烧,产生淡蓝色火焰,烧杯壁上有水珠生成,接触烧杯的手能感觉到发热.结论:铁粉与硫酸铜的溶液反应时,产生的气体是
[思维拓展]由上述实验可以推出,硫酸铜溶液中可能含有
分析:依据铁能和硫酸铜溶液反应生成铜和硫酸亚铁进行书写即可;
【方案设计】(1)运用氧气支持燃烧能使带火星的木条复燃解答;
(2)运用S02与NaOH反应生成亚硫酸钠和水解答;
【实验探究】运用氢气的燃烧现象分析判断;
【思维拓展】运用金属和酸的反应能生成氢气的特点进行解答.
【方案设计】(1)运用氧气支持燃烧能使带火星的木条复燃解答;
(2)运用S02与NaOH反应生成亚硫酸钠和水解答;
【实验探究】运用氢气的燃烧现象分析判断;
【思维拓展】运用金属和酸的反应能生成氢气的特点进行解答.
解答:解:铁能和硫酸铜溶液反应生成铜和硫酸亚铁,其方程式为:Fe+CuSO4=FeSO4+Cu,故答案为:Fe+CuSO4=FeSO4+Cu;
【方案设计】
(1)氧气的鉴定一般是用带火星的木条伸入收集的气体中若复燃说明是氧气,故答案为:用带火星的木条伸入收集的气体中若复燃说明是氧气;
(2)二氧化硫是酸性氧化物,能和强碱反应生成盐和水,S02与过量的NaOH反应生成亚硫酸钠和水,其方程式为:S02+2NaOH=Na2S03+H2O,故答案为:S02+2NaOH=Na2S03+H2O;
【实验探究】氢气可以在空气里安静的燃烧,产生淡蓝色火焰,烧杯壁上有水珠生成,接触烧杯的手能感觉到发热,故答案为:氢气;
【思维拓展】因为活动性在氢前的金属和酸反应能产生氢气,所以可断定该溶液呈酸性,故答案为:酸性;
【方案设计】
(1)氧气的鉴定一般是用带火星的木条伸入收集的气体中若复燃说明是氧气,故答案为:用带火星的木条伸入收集的气体中若复燃说明是氧气;
(2)二氧化硫是酸性氧化物,能和强碱反应生成盐和水,S02与过量的NaOH反应生成亚硫酸钠和水,其方程式为:S02+2NaOH=Na2S03+H2O,故答案为:S02+2NaOH=Na2S03+H2O;
【实验探究】氢气可以在空气里安静的燃烧,产生淡蓝色火焰,烧杯壁上有水珠生成,接触烧杯的手能感觉到发热,故答案为:氢气;
【思维拓展】因为活动性在氢前的金属和酸反应能产生氢气,所以可断定该溶液呈酸性,故答案为:酸性;
点评:本题综合考查了金属的化学性质、氧气的检验、使用氢气的注意事项以及碱的部分性质,解题的关键是进行知识的迁移和灵活运用.

练习册系列答案
 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目