题目内容
(8分)向50mL0.5mol/L的硫酸铝溶液中加入1.5mol/L的KOH溶液多少毫升,可得到1.56gAl(OH)3白色沉淀?
【答案】
40ml或120ml
【解析】
试题分析:硫酸铝的物质的量是0.05L×0.5mol/L=0.025mol
则最多可以生成氢氧化铝的物质的量是0.025mol×2=0.05mol
但实际生成的氢氧化铝是1.56g÷78g/mol=0.02mol
这说明反应中硫酸铝过量或生成的氢氧化铝又部分被溶解
如果;硫酸铝过量,则根据方程式Al3++3OH-=Al(OH)3↓可知
需要氢氧化钾的物质的量是0.02mol×3=0.06mol
因此氢氧化钾溶液的体积是0.06mol÷1.5mol/L=0.04L=40ml
如果生成的氢氧化铝又部分溶解,则根据方程式Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O
可知需要氢氧化钾的物质的量是0.05mol×3+(0.05mol-0.02mol)=0.09mol
所以氢氧化钾溶液的体积是0.18mol÷1.5mol/L=0.12L=120ml
考点:考查氢氧化铝制备的有关计算
点评:本题是高考中的常见计算题,属于中等难度的试题,试题基础性强,侧重学生能力的考查。该题的关键是明确氢氧化铝是两性氢氧化物,在氢氧化钠过量的情况下,会溶解氢氧化铝,然后通过讨论、灵活运用即可。该题有利于培养学生的规范答题能力,也有利于提高学生的应试能力。

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
下列溶液中Cl-的物质的量浓度最大的是( )
| A、50mL 0.5mol/L AlCl3溶液 | B、100mL 0.5mol/L MgCl2溶液 | C、100mL1mol/L NaCl溶液 | D、50mL0.5mol/L HCl溶液 |
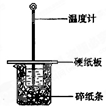 某实验小组学生按照课本实验要求,用50mL0.5mol/L的盐酸50mL0.5mol/L的NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量计算中和热.下列说法正确是( )
某实验小组学生按照课本实验要求,用50mL0.5mol/L的盐酸50mL0.5mol/L的NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量计算中和热.下列说法正确是( )