��Ŀ����
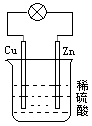
�ҹ��״��ĺ�����������Ϊ����������Ϊ��������ˮΪ�������Һ�������е�����������Ӧ��������������ܷ�ӦΪ��4Al + 3O2 + 6H2O = 4Al(OH)3������˵������ȷ���ǣ� ��
| A��������ӦʽΪ��O2 + 2H2O + 4e- = 4OH- |
| B����ع���ʱ�����������缫�ص������缫 |
| C������״�IJ�Ϊ�������������������ĽӴ���� |
| D���õ��ͨ��ֻ���������Ϳɼ���ʹ�� |
B
������������ݸõ�ص��ܷ�Ӧ֪����ع���ʱ��ʧ���ӣ�����������Ӧ����ԭ��صĸ������缫��ӦʽΪAl-3e-+3OH-=Al��OH��3�������Ͽ����е������õ��ӣ�������ԭ��Ӧ���缫��ӦʽΪO2+2H2O+4e-=4OH-��A�������Ͽ����е������õ��ӣ�������ԭ��Ӧ���缫��ӦʽΪO2+2H2O+4e-=4OH-����ȷ��B����ع���ʱ���������������������Ӳ��缫�ص����������缫������C������״�IJ�Ϊ�������������������ĽӴ��������ȷ��D����ع���ʱ�����缫����������Ӧ����ģ��õ��ͨ��ֻ���������Ϳɼ���ʹ�ã���ȷ��

��ϰ��ϵ�д�
 �¿α�������������ҵ�������γ�����ϵ�д�
�¿α�������������ҵ�������γ�����ϵ�д� ����ν����Ž̲��㽭���̴�ѧ������ϵ�д�
����ν����Ž̲��㽭���̴�ѧ������ϵ�д� �����Ļ������������������ϵ�д�
�����Ļ������������������ϵ�д�
�����Ŀ