题目内容
联氨(N2H4)是一种绿色环保的还原剂,其氧化产物为氮气。
(1)合成联氨的有关反应如下:
NH3(g)+NaClO(aq)=NH2C1(I)+NaOH(aq) △H1=-67.45 kJ ·mol-1
NH2Cl(1)+NaOH(aq)+NH3(g)=N2H4(I)+NaCl(aq)+ H2O(I) △H2 = - 195.32 kJ ·mol-1
反应2NH3(g)+NaClO(ap)=N2H4(I)+NaCl(aq)+H2O(I) △H=__________kJ ·mol-1
(2)联氨为二元弱碱,在水中的电离方式与氨相似.写出联氨与过量盐酸反应的离子方程式_____________。
(3)联氨-空气燃料电池是一种碱性燃料电池,电解质溶液是20%〜30%的KOH溶液。该电池放电时,负极的电极反应式是__________________。
(4)在高温下,N2H4可完全分解为NH3、N2及H2 ,实验测得分解产物中N2与H2的物质的量之比为3:2,,则该分解反应的化学方程式为_____________________。
(5)联氨常用于化学镀镍废料中回收金属镍,反应体系的pH对镍的回收率的影响如下图左所示,则利用联氨回收金属镍时溶液的pH应控制在__________,在确定合适的pH后,取100 mL化学镀镍废液,分别加入不同体积的联氨,镍的冋收率如下图右所示,则联氨的合理用量为_________mL,联氨的体积超过2.5 mL时,金属镍的冋收率降低,其可能的原因是________________。

练习册系列答案
相关题目


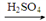 CuSO4(aq)
CuSO4(aq) Cu
Cu NaHCO3
NaHCO3 Na2CO3
Na2CO3 Mg(OH)2
Mg(OH)2 Mg
Mg N2
N2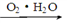 HNO3
HNO3
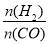 =2通入1L的反应器中,一定条件下发生反应:2CO(g)+4H2(g)
=2通入1L的反应器中,一定条件下发生反应:2CO(g)+4H2(g)  CH3OCH3(g) +H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图所示,下列说法正确的是
CH3OCH3(g) +H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图所示,下列说法正确的是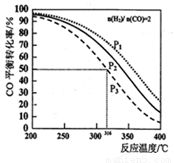
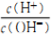 =10-11的溶液:Na+、Ba2+、NO3-、CI-
=10-11的溶液:Na+、Ba2+、NO3-、CI-