题目内容
3.2gCu与过量的8mol/L30mLHNO3反应,硝酸的还原产物为NO2和NO,反应结束后测得溶液中n(H+)为amol,则溶液中所含n(NO3-)为( )A.amol
B.(0.1+a)mol
C.(0.05+a)mol
D.(0.2+a)mol
【答案】分析:n(Cu)=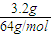 =0.05mol,反应后溶液存在Cu2+、H+、NO3-根据溶液呈电中性原则计算溶液中所含n(NO3-).
=0.05mol,反应后溶液存在Cu2+、H+、NO3-根据溶液呈电中性原则计算溶液中所含n(NO3-).
解答:解:n(Cu)=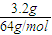 =0.05mol,反应后溶液存在Cu2+、H+、NO3-,
=0.05mol,反应后溶液存在Cu2+、H+、NO3-,
其中n(Cu2+)=0.05mol,n(NO3-)=amol,
根据溶液呈电中性原则,可知溶液中存在:2n(Cu2+)+n(H+)=n(NO3-),
则n(NO3-)=2×0.05mol+amol=(0.1+a)mol,
故选B.
点评:本题考查氧化还原反应的计算,题目难度不大,本题从溶液电中性的角度解答较为简单,也可根据N元素守恒计算.
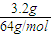 =0.05mol,反应后溶液存在Cu2+、H+、NO3-根据溶液呈电中性原则计算溶液中所含n(NO3-).
=0.05mol,反应后溶液存在Cu2+、H+、NO3-根据溶液呈电中性原则计算溶液中所含n(NO3-).解答:解:n(Cu)=
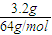 =0.05mol,反应后溶液存在Cu2+、H+、NO3-,
=0.05mol,反应后溶液存在Cu2+、H+、NO3-,其中n(Cu2+)=0.05mol,n(NO3-)=amol,
根据溶液呈电中性原则,可知溶液中存在:2n(Cu2+)+n(H+)=n(NO3-),
则n(NO3-)=2×0.05mol+amol=(0.1+a)mol,
故选B.
点评:本题考查氧化还原反应的计算,题目难度不大,本题从溶液电中性的角度解答较为简单,也可根据N元素守恒计算.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
