题目内容
已知反应:3A(g)+B(g) C(s)+4D(g);△H=-Q kJ/lmol下列分析错误的是( )
C(s)+4D(g);△H=-Q kJ/lmol下列分析错误的是( )
A.在恒温密闭容器中,共加入1molA和B的混合物,发生反应,当A的转化率与B的转化率相等时,则最初加入B的量为0.25mol
B.在恒温下,加入过量的C和1mol的D反应达到平衡后,再加入1molD,同时压强再增大一倍,建立起新的化学平衡后,A的浓度将增加到原平衡的4倍
C.如果在C(s)中含有难熔性的杂质,将其放在下列装置的b点处,并充入一定量的D(g),一段时间后,可在a点处得到纯C(S)
D.当反应向逆反应方向进行时,v逆(B)>3v(A)正
【答案】分析:A、依据反应物的转化率相同,则起始量和变化量按照化学方程式中系数比反应即符合分析判断;
B、依据C为固体,反应前后的气体体积不变,加入C平衡不变,加入D相当于加入相同的平衡,压强增大平衡不变,个平衡状态下的物质浓度都增大为原来的2倍;
C、利用C中含的杂质是难溶物熔沸点高,利用高温区使平衡逆向进行,在a点温度降低平衡正向进行生成C得到纯净C固体;
D、依据反应中正反应速率之比等于系数之比,结合反应逆向进行进行分析判断;
解答:解:A、在恒温密闭容器中,共加入1molA和B的混合物,发生反应,当A的转化率与B的转化率相等时,混合物的起始量一定按照化学方程式中的反应比投料.即1molAB按照3:1组成,A物质的量为0.75mol,B物质的量为0.25mol,故A正确;
B、3A(g)+B(g) C(s)+4D(g);中C为,固体对平衡无影响,反应前后气体体积不变,加入过量的C和1mol的D反应达到平衡后,A的浓度将增加到原平衡的1倍,再加入1molD相当于增大压强,A的浓度又增大到原来的2倍,压强再增大一倍,平衡不动,相当于体积变为原来的一半,建立起新的化学平衡后,A的浓度将增加到原平衡的4倍,故B正确;
C(s)+4D(g);中C为,固体对平衡无影响,反应前后气体体积不变,加入过量的C和1mol的D反应达到平衡后,A的浓度将增加到原平衡的1倍,再加入1molD相当于增大压强,A的浓度又增大到原来的2倍,压强再增大一倍,平衡不动,相当于体积变为原来的一半,建立起新的化学平衡后,A的浓度将增加到原平衡的4倍,故B正确;
C、利用C中含的杂质是难溶物熔沸点高,把含杂质的C放在高温区,通入D气体,反应是放热反应,高温平衡逆向进行,生成ABD的平衡气体在a点温度降低,平衡正向进行,生成纯净C固体,故C正确;
D、反应的正反应速率之比等于系数之比,v正(A):v正(B)=3:1,当反应向逆反应方向进行时对于B,v正(B)<v逆(B),所以v逆(B)> v(A)正,故D错误;
v(A)正,故D错误;
故选D.
点评:本题考查了化学平衡的转化率的判断,影响化学平衡的因素的理解和应用,速率之比等于系数之比的含义.
B、依据C为固体,反应前后的气体体积不变,加入C平衡不变,加入D相当于加入相同的平衡,压强增大平衡不变,个平衡状态下的物质浓度都增大为原来的2倍;
C、利用C中含的杂质是难溶物熔沸点高,利用高温区使平衡逆向进行,在a点温度降低平衡正向进行生成C得到纯净C固体;
D、依据反应中正反应速率之比等于系数之比,结合反应逆向进行进行分析判断;
解答:解:A、在恒温密闭容器中,共加入1molA和B的混合物,发生反应,当A的转化率与B的转化率相等时,混合物的起始量一定按照化学方程式中的反应比投料.即1molAB按照3:1组成,A物质的量为0.75mol,B物质的量为0.25mol,故A正确;
B、3A(g)+B(g)
 C(s)+4D(g);中C为,固体对平衡无影响,反应前后气体体积不变,加入过量的C和1mol的D反应达到平衡后,A的浓度将增加到原平衡的1倍,再加入1molD相当于增大压强,A的浓度又增大到原来的2倍,压强再增大一倍,平衡不动,相当于体积变为原来的一半,建立起新的化学平衡后,A的浓度将增加到原平衡的4倍,故B正确;
C(s)+4D(g);中C为,固体对平衡无影响,反应前后气体体积不变,加入过量的C和1mol的D反应达到平衡后,A的浓度将增加到原平衡的1倍,再加入1molD相当于增大压强,A的浓度又增大到原来的2倍,压强再增大一倍,平衡不动,相当于体积变为原来的一半,建立起新的化学平衡后,A的浓度将增加到原平衡的4倍,故B正确;C、利用C中含的杂质是难溶物熔沸点高,把含杂质的C放在高温区,通入D气体,反应是放热反应,高温平衡逆向进行,生成ABD的平衡气体在a点温度降低,平衡正向进行,生成纯净C固体,故C正确;
D、反应的正反应速率之比等于系数之比,v正(A):v正(B)=3:1,当反应向逆反应方向进行时对于B,v正(B)<v逆(B),所以v逆(B)>
 v(A)正,故D错误;
v(A)正,故D错误;故选D.
点评:本题考查了化学平衡的转化率的判断,影响化学平衡的因素的理解和应用,速率之比等于系数之比的含义.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目
 (2011?双流县模拟)已知反应:3A(g)+B(g)
(2011?双流县模拟)已知反应:3A(g)+B(g) C(s)+4D(g);△H=-Q kJ/lmol下列分析错误的是( )
C(s)+4D(g);△H=-Q kJ/lmol下列分析错误的是( )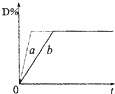 已知反应:3A(g)+B(g)?C(s)+4D(g);△H<0.图中a、b表示在一定条件下,D的体积分数随时间t的变化情况.若使曲线b变为曲线a,可采用的措施是( )
已知反应:3A(g)+B(g)?C(s)+4D(g);△H<0.图中a、b表示在一定条件下,D的体积分数随时间t的变化情况.若使曲线b变为曲线a,可采用的措施是( )