题目内容
由冰铜(mCu2O·nFeS)冶炼得到粗铜,再以粗铜为原料制纯铜的流程如下:
请回答下列问题:
(1)气体X是 。
(2)某研究性学习小组用熔渣Y与CO反应来制取Fe。
①请按气流由左到右的方向连接下列各装置,顺序为A→________。
②装置C的作用是________________。
③在点燃D处的酒精灯前,应进行的操作是__________________。

(3)熔渣Y中铁元素的价态有+2价和+3价,根据限选试剂,设计实验方案验证熔渣Y中有+2价铁元素存在,写出有关实验操作、预期现象与结论。
限选试剂: 3 mol·L-1H2SO4、6 mol·L-1HNO3、3% H2O2、0.01 mol·L-1KMnO4、20% KSCN。
。
(4)写出泡铜冶炼粗铜反应的化学方程式 。
(5)根据限选材料画出用粗铜提炼纯铜的装置图,并进行必要的标注。
限选材料:FeSO4(aq)、CuSO4(aq)、粗铁、纯铁、粗铜、纯铜、烧杯、直流电源、导线。
(1)SO2 或二氧化硫(2分)
(2)E→B→C→D(全对2分) ②除去尾气中的CO2(2分)
③检验CO(尾气)的纯度 (2分)
(3)①取少量熔渣Y于试管中,加入适量(经加热煮沸除氧)3 mol·L-1H2SO4溶液(1分),加热充分溶解,反应后得A溶液(1分)。②取少量A溶液,滴加1-2滴0.01 mol·L-1KMnO4溶液,振荡(1分),若溶液的紫红色褪去(1分),则说明熔渣Y中有+2价铁元素存在。
(其他合理即给分)
(4)3Cu2O+2Al 6Cu+ Al2O3 (2分)
6Cu+ Al2O3 (2分)
(5)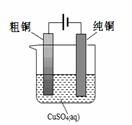 (3分,其中:装置2分,标注1分)
(3分,其中:装置2分,标注1分)
解析试题分析:(1)分析所给的冰铜化学式,其中Cu和Fe焙烧都生成固体氧化物,只有非金属元素S焙烧会生成气体,所以气体X一定是SO2。
(2)①熔渣Y是Fe的氧化物,用CO还原Y制备铁单质,从所给的反应装置来看,B装置是反应制铁装置,通入B中的CO气体不能含有CO2和H2O等杂质气体,因此在A、B之间接上装置E除水;B中反应出来的气体有生成的CO2和过量的CO有毒气体,除CO尾气可用燃烧法,但要注意CO的纯度,防止爆炸,要先用装置C除去尾气中的CO2。所以整个顺序就是A→E→B→C→D。
②装置C的作用是除去尾气中的CO2。
③点燃D处酒精灯除尾气时要验纯。
(3)熔渣Y中的铁元素有+2价和+3价,所以当+2价和+3价Fe元素同时存在时,应该选用高锰酸钾溶液检验其中的+2价铁。
具体步骤:①取少量熔渣Y于试管中,加入适量(经加热煮沸除氧)3 mol·L-1H2SO4溶液,加热充分溶解,反应后得A溶液。
②取少量A溶液,滴加1-2滴0.01 mol·L-1KMnO4溶液,振荡,若溶液的紫红色褪去,则说明熔渣Y中有+2价铁元素存在。
(4)泡铜冶炼粗铜是在高温条件下加入还原剂铝进行冶炼的,所以化学方程式为3Cu2O+2Al 6Cu+ Al2O3 。
6Cu+ Al2O3 。
(5)电解精炼铜是教材中常提到的一个电化学内容,原理比较简单,所以用所提供的材料画出该装置图示比较简单的,但要注意的是各标注要准确。所以图像是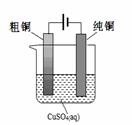
考点:本题考查的是基础实验探究,多以装置连接、气体除杂、尾气吸收为主。

下面是有关物质的转化关系图(有些物质已省略)。
若A为单质,E在常温下为液体,C的相对分子质量为78。请回答下列问题: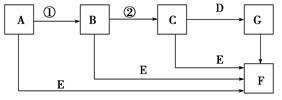
(1)画出A的原子结构示意图________,F的电子式是________。
(2)下面对C物质结构、性质的推断中,不正确的是________。
| A.久置于空气中会变成白色 |
| B.具有强氧化性 |
| C.晶体中存在离子键和共价键 |
| D.遇湿润的紫色石蕊试纸只能使其变蓝色 |
 2Fe(s)+3CO(g) △H=-492.7kJ/mol
2Fe(s)+3CO(g) △H=-492.7kJ/mol


 2Cu+SO2
2Cu+SO2
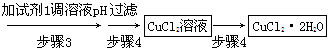
 O2(g)=H2O(l) ΔH3=-286 kJ·mol-1
O2(g)=H2O(l) ΔH3=-286 kJ·mol-1

 2NaAlO2(aq)+4H2O,[Al2O3·3H2O也可表示为2Al(OH)3]
2NaAlO2(aq)+4H2O,[Al2O3·3H2O也可表示为2Al(OH)3]