题目内容
 人类的生活离不开化学,拥有化学知识可以使人类生活得更加自信.
人类的生活离不开化学,拥有化学知识可以使人类生活得更加自信.(1)材料是人类赖以生存和发展的重要物质基础.
①一般情况下,合金比组成它的成分金属硬度
②
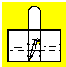
(2)如图,水槽中试管内有一枚铁钉,放置数天观察:
①若液面上升,正极电极反应式为:
②若液面下降,负极电极反应式为:
分析:(1)①与组成合金的纯金属相比,合金的优点一般有强度好、熔点低、抗腐蚀性更好等;
②电化学腐蚀是金属腐蚀的主要原因;锌的活动性比铁强,而铜的活动性比铁要弱;在钢圈表面镀Cr可以使钢圈与水和氧气隔绝;
(2)生铁中含有碳,铁、碳和合适的电解质溶液构成原电池,在弱酸性或中性条件下,铁发生吸氧腐蚀,负极上铁失电子发生氧化反应,正极上氧气得电子和水反应生成氢氧根离子,在酸性条件下,铁发生析氢腐蚀,负极上铁失电子发生氧化反应,正极上氢离子得电子发生还原反应.
②电化学腐蚀是金属腐蚀的主要原因;锌的活动性比铁强,而铜的活动性比铁要弱;在钢圈表面镀Cr可以使钢圈与水和氧气隔绝;
(2)生铁中含有碳,铁、碳和合适的电解质溶液构成原电池,在弱酸性或中性条件下,铁发生吸氧腐蚀,负极上铁失电子发生氧化反应,正极上氧气得电子和水反应生成氢氧根离子,在酸性条件下,铁发生析氢腐蚀,负极上铁失电子发生氧化反应,正极上氢离子得电子发生还原反应.
解答:解:(1)①多数合金硬度大于组成它的成分金属,熔点低于组成它的成分金属的熔点;
故答案为:大;
②电化学腐蚀是金属腐蚀的主要原因;锌的活动性比铁强,而铜的活动性比铁要弱,为保护钢制外壳,一般应选择锌板;在钢圈表面镀Cr既可以使钢圈与水和氧气隔绝,从而防止生锈,又可以使钢圈保持金属光泽;
故答案为:电化学;锌;镀Cr;
(2)生铁中含有碳,铁、碳和合适的电解质溶液构成原电池,
①若试管内液面上升,说明电解质环境是碱性或是中性,试管内气体因和水反应而使其压强减小,发生的是吸氧腐蚀,铁作负极,负极电极反应式为:Fe-2e-═Fe2+,正极电极反应式为:2H2O+O2+4e-═4OH-,
故答案为:2H2O+O2+4e-═4OH-;
②若试管内液面下降,说明金属的腐蚀中生成气体导致压强增大,则金属发生的是析氢腐蚀,溶液呈酸性,负极上铁失电子发生氧化反应,电极反应式为:Fe-2e-═Fe2+,正极上氢离子得电子发生还原反应,电极反应式为:4H++4e-═2H2↑,
故答案为:Fe-2e-═Fe2+.
故答案为:大;
②电化学腐蚀是金属腐蚀的主要原因;锌的活动性比铁强,而铜的活动性比铁要弱,为保护钢制外壳,一般应选择锌板;在钢圈表面镀Cr既可以使钢圈与水和氧气隔绝,从而防止生锈,又可以使钢圈保持金属光泽;
故答案为:电化学;锌;镀Cr;
(2)生铁中含有碳,铁、碳和合适的电解质溶液构成原电池,
①若试管内液面上升,说明电解质环境是碱性或是中性,试管内气体因和水反应而使其压强减小,发生的是吸氧腐蚀,铁作负极,负极电极反应式为:Fe-2e-═Fe2+,正极电极反应式为:2H2O+O2+4e-═4OH-,
故答案为:2H2O+O2+4e-═4OH-;
②若试管内液面下降,说明金属的腐蚀中生成气体导致压强增大,则金属发生的是析氢腐蚀,溶液呈酸性,负极上铁失电子发生氧化反应,电极反应式为:Fe-2e-═Fe2+,正极上氢离子得电子发生还原反应,电极反应式为:4H++4e-═2H2↑,
故答案为:Fe-2e-═Fe2+.
点评:本题考查了合金的性质以及钢铁的电化学腐蚀,注意酸性条件下钢铁发生析氢腐蚀,弱酸性或中性条件下钢铁发生吸氧腐蚀.

练习册系列答案
 优加精卷系列答案
优加精卷系列答案
相关题目