题目内容
【题目】化学电源在生产生活中有着广泛的应用,请回答下列问题:
(1)根据构成原电池的本质判断,下列化学反应方程式正确且能设计成原电池的是_________。
A.KOH + HCl = KCl + H2O B. Cu + Fe3+ = Fe2+ + Cu2+
C.Na2O + H2O = 2NaOH D.Fe + H2SO4 = FeSO4 + H2↑
(2)为了探究化学反应中的能量变化,某同学设计了如下两个实验(如下图)。有关实验现象,下列说法正确的是:______。
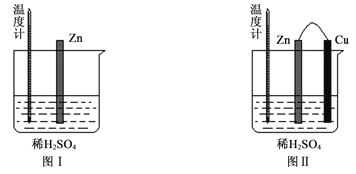
A.图I中温度计的示数高于图II的示数
B.图I和图II中温度计的示数相等,且均高于室温
C.图I和图II的气泡均产生于锌棒表面
D.图II中产生气体的速度比I慢
(3)电动汽车上用的铅蓄电池是以一组充满海绵状态铜的铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解质溶液。放电时总反应为:Pb+PbO2+2H2SO4=2PbSO4+2H2O
①写出放电时正极的电极反应式:___________;
②铅蓄电池放电时,负极质量将_______(填“增大”、“减小”或“不变”)。当外电路上有2mol电子通过时,溶液中消耗H2SO4的物质的量为_________。
【答案】D A PbO2 + 2e- + SO42-+4H+ = PbSO4 + 2H2O 增大 2mol
【解析】
(1)依据原电池反应是自发进行的氧化还原化学反应判断;
(2)依据图Ⅰ中发生的是锌的化学腐蚀,图Ⅱ形成铜-锌原电池判断;
(3)根据铅蓄电池正极发生还原反应,负极发生氧化反应判断。
(1)电池的构成原理是自发进行的氧化还原反应在理论上可以设计成原电池
A.KOH+HCl=KCl+H2O是复分解反应,不是氧化还原反应,故A错误;
B.Cu +Fe3+ =Fe2+ +Cu2+电荷不守恒,离子方程式不正确,故B错误;
C.Na2O+H2O=2NaOH是化合反应,不是氧化还原反应,故C错误;
D.Fe +H2SO4 =FeSO4+H2↑,反应是自发进行的氧化还原反应,可以设计成原电池,故D正确。
故答案为:D。
(2)图Ⅰ中发生的是锌的化学腐蚀,图Ⅱ形成铜-锌原电池
A.图Ⅰ主要将化学能转化为热能,而图Ⅱ主要将化学能转化为电能,则图I中温度计的示数高于图II的示数,故A正确;
B.由A分析可知,图I和图II中温度计的示数不相等,但均高于室温,故B错误;
C.图II铜为正极,铜的表面有气泡产生,故C错误;
D.利用原电池反应可以使金属与酸的反应速率加快,故图II中产生气体的速度比I快,故D错误。
故答案为:A。
(3)①依据放电时总反应为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,PbO2得电子发生还原反应,PbO2在H2SO4溶液中生成难溶于水的PbSO4,故其正极反应式为PbO2+2e-+SO42-+4H+=PbSO4+2H2O,故答案为:PbO2+2e-+SO42-+4H+=PbSO4+2H2O。
②依据放电时总反应为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,Pb失电子发生氧化反应,产生的Pb2+在H2SO4溶液中结合SO42-生成难溶于水的PbSO4,故负极质量将增大,根据总反应,转移2mol电子时,消耗2molH2SO4,所以当外电路上有2mol电子通过时,溶液中消耗H2SO4的物质的量为2mol,故答案为:增大,2mol。




