题目内容
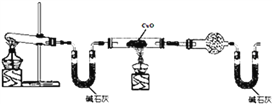
【题目】某实验小组设计了如下装置对焦炭还原二氧化硅的气体产物的成分进行探究。

已知:PdCl2溶液可用于检验CO,反应的化学方程式为CO + PdCl2 + H2O = CO2 + 2HCl + Pd(产生黑色金属钯粉末,使溶液变浑浊)。
(1)实验时要通入足够长时间的N2,其原因是________________________。
(2)装置B的作用是____________________________。
(3)装置C、D中所盛试剂分别为___、___,若装置C、D中溶液均变浑浊,且经检测两气体产物的物质的量相等,则该反应的化学方程式为____________________________。
(4)该装置的缺点是____________________________。
(5)设计实验证明碳酸的酸性比硅酸的强:____________________________。
【答案】 要用氮气将装置中的空气排尽,避免空气中的氧气、二氧化碳、水蒸气对实验产生干扰 作安全瓶,防止倒吸 澄清石灰水 PdCl2溶液 3SiO2+4C![]() 2CO2↑+2CO↑+3Si 没有尾气处理装置将CO吸收 向硅酸钠溶液中通入二氧化碳气体,溶液变浑浊,证明碳酸酸性大于硅酸
2CO2↑+2CO↑+3Si 没有尾气处理装置将CO吸收 向硅酸钠溶液中通入二氧化碳气体,溶液变浑浊,证明碳酸酸性大于硅酸
【解析】(1)碳与二氧化硅反应要在高温下进行,高温下,碳与空气中氧气也能反应,所以实验时要将装置中的空气排尽,所以实验时要通入足够长时间的N2,故答案为:要用氮气将装置中的空气排尽,避免空气中的氧气、二氧化碳、水蒸气对实验产生干扰;
(2)根据装置图可知,B装置可以作安全瓶,防止倒吸,故答案为:作安全瓶,防止倒吸;
(3)根据元素守恒,碳与二氧化硅反应可能生成一氧化碳也可能生成二氧化碳,所以C装置用来检验有没有二氧化碳,D装置用来检验一氧化碳,所以置C、D中所盛试剂分别为澄清石灰水、PdCl2溶液;若装置C、D中溶液均变浑浊,说明既有二氧化碳又有一氧化碳,检测两气体产物的物质的量相等,根据元素守恒可知化学方程式为3SiO2+4C![]() 2CO2+2CO+3Si,故答案为:澄清石灰水;PdCl2溶液;3SiO2+4C
2CO2+2CO+3Si,故答案为:澄清石灰水;PdCl2溶液;3SiO2+4C![]() 2CO2+2CO+3Si;
2CO2+2CO+3Si;
(4)一氧化碳有毒,有能排放到空气中,而该装置没有尾气吸收装置将CO吸收,故答案为:没有尾气吸收装置将CO吸收;
(5)验证碳酸、硅酸的酸性强弱,产生的CO2气体先通过饱和的碳酸氢钠溶液除去混有的杂质气体,然后再通入硅酸钠溶液发生反应CO2+H2O+Na2SiO3=Na2CO3+H2SiO3↓,说明酸性H2CO3>H2SiO3,故答案为:向硅酸钠溶液中通入二氧化碳气体,溶液变浑浊,证明碳酸酸性大于硅酸。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案【题目】满足下列条件的有机物的种类数正确的是
选项 | 有机物 | 条件 | 种类数 |
A |
| 该有机物的一氯代物 | 4 |
B | C6H12O2 | 能与NaHCO3溶液反应 | 3 |
C | C5H12O | 含有2个甲基的醇 | 5 |
D | C5H10O2 | 在酸性条件下会水解生成甲和乙,且甲、乙的相对分子质量相等 | 4 |
A. A B. B C. C D. D