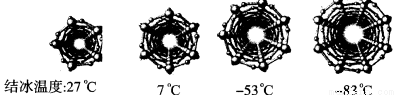
题目内容
A、B、C、D四种元素处于同一短周期,在同族元素中,A的气态氢化物的沸点最高,B的最高价氧化物对应的水化物的酸性在同周期中是最强的,C的电负性介于A、B之间,D与B相邻。
请填空:
(1)在B的单质分子中存在________个π键,________个σ键。
(2)已知B的气态氢化物很容易与H+结合,B原子与H+间形成的键叫________,形成的离子立体构型为________,其中B原子采取的杂化方式是________。
(3)在A、B、C、D四种元素形成的电子数相同的四种氢化物中,沸点最低的是________(写分子式),其沸点显著低于其他三种氢化物的原因是:________________________。
(4)A的氢化物易溶于水,而D的氢化物难溶于水,原因是___________________________。
(1)2 1
(2)配位键 正四面体形 sp3杂化
(3)CH4 CH4分子间只有范德华力没有氢键,而NH3、H2O、HF分子间还存在氢键
(4)HF和H2O均为极性分子,CH4为非极性分子
【解析】解答该题,首先根据题给各元素的原子结构和性质正确推导各元素;然后根据各小题所考查的知识分析作答。根据题给信息,A为短周期元素,其气态氢化物的相对分子质量在同族元素氢化物中不是最大的,而沸点最高,说明A的氢化物可形成氢键,故A可能是N、O、F中的一种,则A、B、C、D为第二周期元素,B的最高价氧化物对应的水化物的酸性在同周期中是最强的,则B为N,C的电负性介于A、B之间,则C为O,A为F;D与B相邻则为碳。
(1)B单质即N2,其结构式为N≡≡N,三键中有一个σ键,2个π键。
(2)NH3分子中N原子上有一对孤对电子,可与H+以配位键结合成NH4+,据价电子对互斥理论知,该微粒为正四面体形,其中N的杂化方式为sp3杂化。
(3)F的氢化物只有一种HF,电子数为10,其他有10个电子的氢化物分别是NH3、H2O、CH4,其中CH4沸点最低,因为只有CH4分子间不能形成氢键,其他三种分子间均形成氢键,故它们的氢化物沸点显著高于CH4。

下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是 ( )
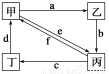
编号 | 甲 | 乙 | 丙 | 丁 |
① | Cu | CuO | CuSO4 | Cu(NO3)2 |
② | Na2CO3 | NaOH | NaHCO3 | CO2 |
③ | N2 | NH3 | NO | NO2 |
④ | CH3CH2Br | C2H5OH | CH2=CH2 | CH3CH3 |
A.①②③④ B.①②③ C.①③④ D.②③④