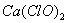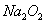题目内容
实验室制取氯气,将多余的氯气用100 ml 1.7mol/L的NaOH溶液完全吸收。对吸收后的溶液进行分析化验,测知c(OH-)="0.1mol/L" (不考虑反应前后溶液的体积变化) 。ClO-和ClO3-的物质的量浓度之比为5∶1。请回答:
(1)吸收氯气消耗的NaOH的物质的量为_______________mol。
(2)被氧化的氯气的物质的量为_______________mol,被还原的氯气的物质的量为 _______________mol。
(3)若采用二氧化锰和浓盐酸共热的方法制氯气,制备尾气中的氯气所消耗的二氧化锰的质量为_______________g。
(1)吸收氯气消耗的NaOH的物质的量为_______________mol。
(2)被氧化的氯气的物质的量为_______________mol,被还原的氯气的物质的量为 _______________mol。
(3)若采用二氧化锰和浓盐酸共热的方法制氯气,制备尾气中的氯气所消耗的二氧化锰的质量为_______________g。
(1)0.16 (2)0.03 , 0.05 (3) 6.96
试题分析:⑴反应前NaOH的物质的量为:0.1 L×1.7 mol/L =" 0.17" mol
反应后NaOH的物质的量为:0.1 L×0.1 mol/L =" 0.01" mol
消耗的NaOH物质的量为:0.16 mol
⑵根据反应8Cl2+16NaOH=5NaClO+NaCIO3+10NaCl+8H2O
则反应掉的氯气有0.16 / 16×8=0.08mol
其中被氧化的氯气即为0.08 \ 8×6=0.03mol
被还原的氯气即为0.08-0.03=0.05mol
⑶ 由(2)可知,尾气中的氯气为0.08mol
MnO2————Cl2
87g 1 mol
Xg 0.08mol
则m(MnO2) =87g×0.08mol/1mol="6." 96 g
点评:氧化还原反应的相关计算是化学计量中难度最大的内容,主要采用守恒法进行解答。

练习册系列答案
相关题目
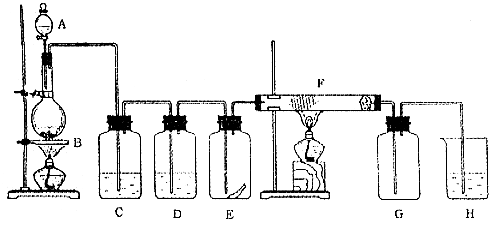 试回答:
试回答: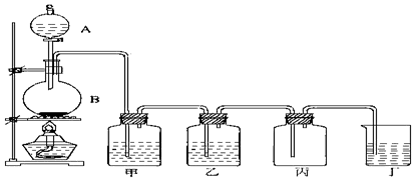
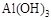 是两性氢氧化物,能溶于强酸或强碱。
是两性氢氧化物,能溶于强酸或强碱。