题目内容
下列物质中常温下既能与NaOH溶液反应,又能与盐酸反应产生氢气的是
A.Mg
B.Cl2
C.Si
D.Al
(1)在密闭容器中,反应aA(g) bB(g)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新平衡时,A物质的量浓度变为原来的60%,则ab(填“>、=、<”),简述其理由。
bB(g)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新平衡时,A物质的量浓度变为原来的60%,则ab(填“>、=、<”),简述其理由。
(2)在恒温时,在固定容器中充入 N2O4,发生反应N2O4(g)
N2O4,发生反应N2O4(g) 2NO2(g),在达到平衡后,若又向容器中充入一定量的N2O4,当达到新平衡时,反应体系中NO2(g)的体积分数将(增大、减小、不变)。
2NO2(g),在达到平衡后,若又向容器中充入一定量的N2O4,当达到新平衡时,反应体系中NO2(g)的体积分数将(增大、减小、不变)。
(3)在一定体积的密闭容器中,进行反应:CO2(g)+H2(g) CO(g)+H2O(g),其反应化学平衡常数和T的关系如下表所示:
CO(g)+H2O(g),其反应化学平衡常数和T的关系如下表所示:
T/℃ | 700 | 800 | 830 | 1000 | 1200[来 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
A.对于CO(g)+H2O(g) CO2(g)+H2(g)此平衡体系,升温平衡向移动。
CO2(g)+H2(g)此平衡体系,升温平衡向移动。
B.达到平衡后,若压缩 容器的体积,正逆反应速率的变化是。
容器的体积,正逆反应速率的变化是。
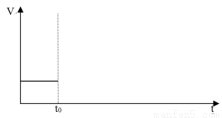
C.对原平衡,在t0时升高温度对化学反应速率产生影响,请在下图中绘出速率变化图:
下列根据实验操作和现象所得出的结论不正确的是( )
选项 | 实验操作 | 实验现象 | 结论 |
A | 向某溶液中加入盐酸酸化的BaCl2溶液 | 生成白色沉淀 | 该溶液中不一定含有SO42﹣ |
B | 步骤1:将少量的溴水滴入FeCl2、NaI的混合溶液中,再滴加CCl4,振荡、静置; 步骤2:向上层溶液中滴加KSCN溶液,再向上层溶液中滴加溴水 | 步骤1现象: 液体分层,下层溶液呈紫色; 步骤2现象: 滴加KSCN溶液,上层溶液不变红;滴加溴水后,上层溶液变红 | 氧化性:Br2>Fe3+>I2 |
C | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
D | 将一片铝箔置于酒精灯外焰上灼烧 | 铝箔熔化但不滴落 | 铝箔表面有致密Al2O3薄膜,且Al2O3熔点高于Al |


 量是0.5mol
量是0.5mol (aq)=Na2SO4(aq)+2H2O(l)∆H=-114.6KJ/mol
(aq)=Na2SO4(aq)+2H2O(l)∆H=-114.6KJ/mol