题目内容
由镁、铝、铁三种金属单质中的两种组成的混合物共6g,与足量的稀盐酸反应,产生标准状况下的氢气2.8L,由此得出的结论中正确的是
- A.混合物中一定含有铝
- B.混合物中一定含有铁
- C.该混合物一定是由铁和镁组成的
- D.混合物中一定不含有铁
B
分析:根据n=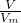 计算氢气的体积,根据电子转移守恒计算提供1mol电子需要金属的平均质量,计算提供1mol电子需要各金属的质量,根据平均值判断.
计算氢气的体积,根据电子转移守恒计算提供1mol电子需要金属的平均质量,计算提供1mol电子需要各金属的质量,根据平均值判断.
解答:标准状况下,2.8L氢气的物质的量=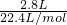 =0.125mol,
=0.125mol,
根据电子转移守恒可知,6g混合金属提供电子的物质的量为0.125mol×2=0.25mol,
故提供1mol电子需要混合金属的平均质量为6g×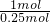 =24g,
=24g,
镁与盐酸反应表现+2价,提供1mol电子需要Mg的质量为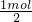 ×24g/mol=12g,
×24g/mol=12g,
铝与盐酸反应表现+3价,提供1mol电子需要Al的质量为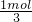 ×27g/mol=9g,
×27g/mol=9g,
铁与盐酸反应表现+2价,提供1mol电子需要Fe的质量为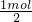 ×56g/mol=28g,
×56g/mol=28g,
Fe提供1mol电子的质量大于24g,Mg、Al提供1mol电子的质量小于24g,故一定含有Fe,Mg、Al至少含有一种,
故选B.
点评:本题考查混合物的有关计算,难度不大,注意利用平均值法与极限法的利用.
分析:根据n=
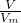 计算氢气的体积,根据电子转移守恒计算提供1mol电子需要金属的平均质量,计算提供1mol电子需要各金属的质量,根据平均值判断.
计算氢气的体积,根据电子转移守恒计算提供1mol电子需要金属的平均质量,计算提供1mol电子需要各金属的质量,根据平均值判断.解答:标准状况下,2.8L氢气的物质的量=
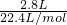 =0.125mol,
=0.125mol,根据电子转移守恒可知,6g混合金属提供电子的物质的量为0.125mol×2=0.25mol,
故提供1mol电子需要混合金属的平均质量为6g×
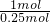 =24g,
=24g,镁与盐酸反应表现+2价,提供1mol电子需要Mg的质量为
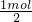 ×24g/mol=12g,
×24g/mol=12g,铝与盐酸反应表现+3价,提供1mol电子需要Al的质量为
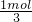 ×27g/mol=9g,
×27g/mol=9g,铁与盐酸反应表现+2价,提供1mol电子需要Fe的质量为
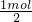 ×56g/mol=28g,
×56g/mol=28g,Fe提供1mol电子的质量大于24g,Mg、Al提供1mol电子的质量小于24g,故一定含有Fe,Mg、Al至少含有一种,
故选B.
点评:本题考查混合物的有关计算,难度不大,注意利用平均值法与极限法的利用.

练习册系列答案
相关题目
下列图示与对应的叙述相符的是( )
A、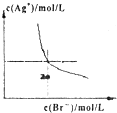 如图是某温度下将AgBr溶于水,c(Ag+)、c(Br-)的关系曲线,a点表示不饱和溶液 | B、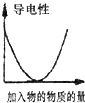 如图可能是在醋酸溶液中不断加入氨水,溶液的导电性情况 | C、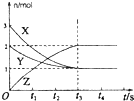 由图知,该反应的化学方程式为:3X+2Y=2Z | D、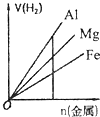 如图是可能镁、铝、铁与足量盐酸的反应,纵坐标表示的是生成氢气体积,横坐标表示的是三种金属的物质的量 |