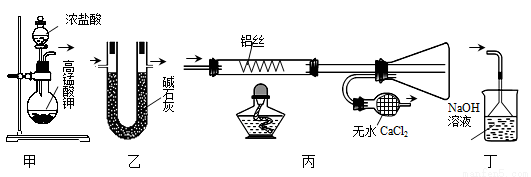
题目内容
常温下,向20.00 mL 0.1000 mol·L—1 (NH4)2SO4溶液中逐滴加入0.2000 mol·L—1NaOH时,溶液的pH与所加NaOH溶液体积的关系如下图所示(不考虑挥发)。下列说法正确的是
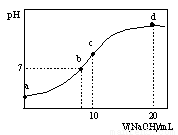
A.点a所示溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-)
B.点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-)
C.点c所示溶液中:c(SO42-)+ c(H+)= c(NH3·H2O )+ c(OH-)
D.点d所示溶液中:c(SO42-)>c(NH3·H2O )>c(OH-)>c(NH4+)
练习册系列答案
相关题目
在含有FeCl3、FeCl2、AlCl3、NaCl的溶液中,加入足量的NaOH溶液,在空气中充分搅拌反应后再加入过量的稀盐酸,溶液中离子数目减少的是
A.Na+ B.Fe3+ C.Al3+ D.Fe2+
在一定条件下,X既能与Y反应又能与Z反应,且都属于复分解反应的是
选项 | X | Y | Z |
A | Cu | HNO3 | Fe(NO3)3 |
B | FeCl3 | Zn | NaHCO3 |
C | O2 | NH3 | SO2 |
D | NH4Al(SO4)2 | Ba(NO3)2 | NaOH |
A. A B. B C. C D. D


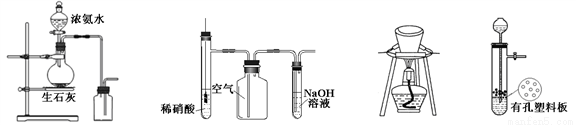
 Ca B. 氮分子的电子式::N:::N:
Ca B. 氮分子的电子式::N:::N: D. 聚乙炔的结构简式:
D. 聚乙炔的结构简式: