题目内容
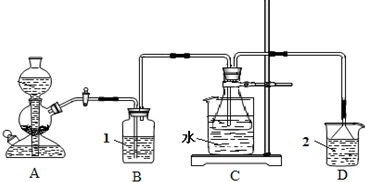
(2011?平顶山二模)碳酸钠俗称纯碱、苏打,是一种常用的日用化学品.在实验室里,可用如图所示装置,以氯化钠、二氧化碳、氨等为原料制备纯碱.实验时,先检验装置的气密性,再向各仪器中加入试剂,打开启普发生器(装置A)活塞,产生二氧化碳气体,制备纯碱.请回答以下有关问题:
(1)碳酸氢钠受热分解的化学方程式为
(2)实验中,要注意控制二氧化碳的通入速度(以出现能数得清的连续气泡为好)和水浴的温度.实验中不能过快的通入二氧化碳的目的是
实验时,锥形瓶中产生了NH4HCO3、NaCl、NaHCO3和NH4Cl的混合液.右表是四种化合物在部分温度下的溶解度.由表中数据可知,反应时水浴的温度不能超过
(3)饱和食盐水,还可以通过电解过程制取烧碱.制备过程中,烧碱溶液主要在电解池的

(1)碳酸氢钠受热分解的化学方程式为
2NaHCO3
Na2CO3+H2O+CO2↑
| ||
2NaHCO3
Na2CO3+H2O+CO2↑
;实验时装置A中发生反应的化学方程式为
| ||
CaCO3+2HCl=CaCl2+H2O+CO2↑
CaCO3+2HCl=CaCl2+H2O+CO2↑
;C装置的锥形瓶中,装有含氨的饱和食盐水,则溶液1应为饱和碳酸氢钠溶液
饱和碳酸氢钠溶液
,溶液2应为稀硫酸
稀硫酸
.(2)实验中,要注意控制二氧化碳的通入速度(以出现能数得清的连续气泡为好)和水浴的温度.实验中不能过快的通入二氧化碳的目的是
增大二氧化碳的吸收率
增大二氧化碳的吸收率
.化学实验中水浴加热法的优点为利于控制反应体系的温度和使其受热均匀
利于控制反应体系的温度和使其受热均匀
.实验时,锥形瓶中产生了NH4HCO3、NaCl、NaHCO3和NH4Cl的混合液.右表是四种化合物在部分温度下的溶解度.由表中数据可知,反应时水浴的温度不能超过
40
40
℃.反应结束,将反应混合液冷却到15℃左右,析出的固体应主要含有NaHCO3
NaHCO3
(填化学式).| 温度 | 10℃ | 20℃ | 30℃ | 40℃ |
| 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 |
| 碳酸氢铵 | 15.8 | 21.0 | 27.0 | 分解 |
| 碳酸氢钠 | 8.1 | 9.6 | 11.1 | 12.7 |
| 氯化铵 | 33.3 | 37.2 | 41.4 | 45.8 |
阴
阴
极区产生,原因是该极区氢离子放电,产生出氢氧根离子
该极区氢离子放电,产生出氢氧根离子
.分析:(1)碳酸氢钠受热分解生成碳酸钠、水、二氧化碳;依据装置图分析可知A装置是制取二氧化碳气体的装置,利用碳酸钙和盐酸反应生成,避免二氧化碳气体中的氯化氢进入C影响晶体析出,先通过饱和碳酸氢钠溶液除去氯化氢;反应过程中氨气是污染气体,不能排放到大气中,需要进行尾气吸收;
(2)实验中不能过快的通入二氧化碳,保证二氧化碳充分吸收反应,提高二氧化碳气体的利用率,水浴加热的优点是加热均匀,温度易于控制;依据图表数据分析,水浴温度不能超过40°C,因为温度再高碳酸氢铵分解,碳酸氢钠不利于析出;
(3)电解饱和食盐水,阴极氢离子得到电子生成氢气,电极附近氢氧根离子浓度增大;
(2)实验中不能过快的通入二氧化碳,保证二氧化碳充分吸收反应,提高二氧化碳气体的利用率,水浴加热的优点是加热均匀,温度易于控制;依据图表数据分析,水浴温度不能超过40°C,因为温度再高碳酸氢铵分解,碳酸氢钠不利于析出;
(3)电解饱和食盐水,阴极氢离子得到电子生成氢气,电极附近氢氧根离子浓度增大;
解答:解:(1)碳酸氢钠受热分解生成碳酸钠、水、二氧化碳,反应的化学方程式为:2NaHCO3
Na2CO3+H2O+CO2↑; A装置是制取二氧化碳气体的装置,利用碳酸钙和盐酸反应生成,反应的化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;为避免二氧化碳中的氯化氢进入C影响晶体析出,先通过饱和碳酸氢钠溶液除去氯化氢;反应过程中氨气是污染气体,不能排放到大气中,需要进行尾气吸收;
故答案为:2NaHCO3
Na2CO3+H2O+CO2↑;
CaCO3+2HCl=CaCl2+H2O+CO2↑; 饱和碳酸氢钠溶液;稀硫酸;
(2)实验中,要注意控制二氧化碳的通入速度(以出现能数得清的连续气泡为好)和水浴的温度.实验中不能过快的通入二氧化碳的目的是:增大二氧化碳的吸收率; 水浴加热的优点是:利于控制反应体系的温度和使其受热均匀;依据图表数据分析,水浴温度不能超过40°C,因为温度再高碳酸氢铵分解,碳酸氢钠晶体不利于析出;将反应混合液冷却到15℃左右,碳酸氢钠的溶解度最小,析出的固体应主要含有NaHCO3;
故答案为:增大二氧化碳的吸收率;利于控制反应体系的温度和使其受热均匀;40; NaHCO3;
(3)电解饱和食盐水,阴极氢离子得到电子生成氢气,电极附近氢氧根离子浓度增大,氢原子氢氧化钠在阴极附近生成;
故答案为:阴; 该极区氢离子放电,产生出氢氧根离子;
| ||
故答案为:2NaHCO3
| ||
CaCO3+2HCl=CaCl2+H2O+CO2↑; 饱和碳酸氢钠溶液;稀硫酸;
(2)实验中,要注意控制二氧化碳的通入速度(以出现能数得清的连续气泡为好)和水浴的温度.实验中不能过快的通入二氧化碳的目的是:增大二氧化碳的吸收率; 水浴加热的优点是:利于控制反应体系的温度和使其受热均匀;依据图表数据分析,水浴温度不能超过40°C,因为温度再高碳酸氢铵分解,碳酸氢钠晶体不利于析出;将反应混合液冷却到15℃左右,碳酸氢钠的溶解度最小,析出的固体应主要含有NaHCO3;
故答案为:增大二氧化碳的吸收率;利于控制反应体系的温度和使其受热均匀;40; NaHCO3;
(3)电解饱和食盐水,阴极氢离子得到电子生成氢气,电极附近氢氧根离子浓度增大,氢原子氢氧化钠在阴极附近生成;
故答案为:阴; 该极区氢离子放电,产生出氢氧根离子;
点评:本题考查了实验室利用工业制纯碱的原理制备碳酸钠的实验设计和装置分析,碳酸氢钠的溶解度分析,实验操作注意问题是解题的关键,题目难度中等.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
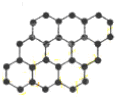 (2011?平顶山二模)石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如下),可由石墨剥离而成,具有极好的应用前景.下列说法正确的是( )
(2011?平顶山二模)石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如下),可由石墨剥离而成,具有极好的应用前景.下列说法正确的是( ) 2CH3OH+3O2+4OH-,则下列说法正确的是( )
2CH3OH+3O2+4OH-,则下列说法正确的是( )