题目内容
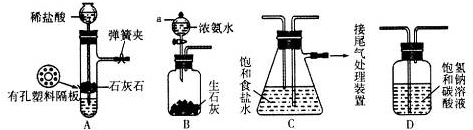
12.氨基甲酸铵(NH2COONH4)是一种白色固体,受热易分解.某小组模拟制备氨基甲酸铵的反应为:2NH3(g)+CO2(g)?NH2COONH4(s)△H<0.(温度对反应的影响比较灵敏)(1)如图装置和选用的试剂制取氨气,其中错误的是AC.
(2)制备氨基甲酸铵的装置如图所示,把NH3和CO2通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵的小晶体悬浮在CCl4中. 当悬浮物较多时,停止制备.(注:CCl4与液体石蜡均为惰性介质.)
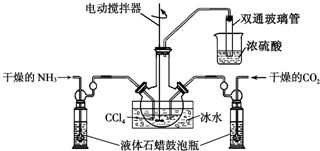
①发生器用冰水冷却的原因是降温提高反应物转化率、防止产物分解;液体石蜡鼓泡瓶的作用是通过观察气泡,调节NH3与CO2通入比例;双通玻璃管的作用是防止倒吸.
②从反应后的混合物中分离出产品的实验方法是过滤(填写操作名称).为了得到干燥产品,应采取的方法是c(填写选项序号).
a.常压加热烘干 b.高压加热烘干 c.减压40℃以下烘干
(3)制得的氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种.请利用下列试剂,设计实验方案,对制得的氨基甲酸铵中的杂质进行成分探究.限选试剂:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、稀盐酸.
分析 本题是探究模拟工业原理制备氨基甲酸铵,涉及利用浓氨水与氢氧化钠固体制备氨气,再将氨气和二氧化碳通入四氯化碳中,不断搅拌混合生成氨基甲酸铵,因反应是放热反应,为了防止产物因温度高分解及提高反应物的转化率,选择利用冰水进行水浴降温,另外还涉及到产品的提纯及尾气的处理,
(1)A、装置中氯化铵受热分解生成氨气和氯化氢,氨气和氯化氢在冷却时又结合成氯化铵,会堵塞导管;
B、将浓氨水滴入氧化钙中,氧化钙与水反应放热,促使氨气挥发,可以制得氨气;
C、氯化铵与氢氧化钙加热分解生成氨气,同时有水生成,试管口高于试管底,水会流入试管底部,会使试管破裂;
D、浓氨水加热,促使氨气挥发,可以制得氨气;
(2)①反应是放热反应降温平衡正向进行,液体石蜡鼓泡瓶的主要作用是控制反应进行程度,控制气体流速和原料气体的配比;依据反应过程中的产物分析,不能把污染性的气体排放到空气中,吸收易溶于水的气体需要放倒吸;
②生成的氨基甲酸铵小晶体悬浮在四氯化碳中,利用过滤得到的氨基甲酸铵(NH2COONH4)是一种白色固体,易分解,应选择低温干燥;
(3)根据实验目的,检验氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种,通过向试管中加入过量的BaCl2溶液,静置溶液不变浑浊,证明固体中不含碳酸铵;在不含碳酸铵的基础上在通过向试管中加入少量澄清石灰水,看溶液是否变浑浊证明固体中是否含有碳酸氢铵;
解答 解:本题是探究模拟工业原理制备氨基甲酸铵,涉及利用浓氨水与氢氧化钠固体制备氨气,再将氨气和二氧化碳通入四氯化碳中,不断搅拌混合生成氨基甲酸铵,因反应是放热反应,为了防止产物因温度高分解及提高反应物的转化率,选择利用冰水进行水浴降温,另外还涉及到产品的提纯及尾气的处理,
(1)A、装置中氯化铵受热分解生成氨气和氯化氢,氨气和氯化氢在冷却时又结合成氯化铵,会堵塞导管,故A有错误;
B、将浓氨水滴入氧化钙中,氧化钙与水反应放热,促使氨气挥发,可以制得氨气,故B正确;
C、氯化铵与氢氧化钙加热分解生成氨气,同时有水生成,试管口高于试管底,水会流入试管底部,会使试管破裂,故C有错误;
D、浓氨水加热,促使氨气挥发,可以制得氨气,故D正确;
故选AC;
(2)①反应2NH3(g)+CO2(g)?NH2COONH4(s)+Q,是放热反应,降温平衡正向进行,温度升高;发生器用冰水冷却提高反应物质转化率,防止生成物温度过高分解,液体石蜡鼓泡瓶的作用是控制反应进行程度,控制气体流速和原料气体的配比,双通玻璃管的作用是防止液体倒吸,
故答案为:降温提高反应物转化率、防止产物分解;通过观察气泡,调节NH3与CO2通入比例;防止倒吸;
②生成的氨基甲酸铵小晶体悬浮在四氯化碳中,利用过滤得到的氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、不能加热烘干,应在真空40℃以下烘干,故选c,故答案为:过滤;c;
③根据实验目的,检验氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种,实验操作为取少量固体样品于试管中,加入蒸馏水至固体溶解,向试管中加入过量的BaCl2溶液,若溶液不变浑浊,证明固体中不含碳酸铵,否则含有碳酸铵;取试管中的上层清液,滴加澄清石灰水,若变浑浊,证明固体中含有碳酸氢铵,否则不含碳酸氢铵,
故答案为:取少量固体样品于试管中,加入蒸馏水至固体溶解,向试管中加入过量的BaCl2溶液,若溶液不变浑浊,证明固体中不含碳酸铵,否则含有碳酸铵;取试管中的上层清液,滴加澄清石灰水,若变浑浊,证明固体中含有碳酸氢铵,否则不含碳酸氢铵.
点评 本题考查了物质制备实验的设计应用,主要是氨气的制备方法,氨基甲酸的制备实验装置分析判断,实验基本操作,混合物分离的实验设计,有关混合物的计算,题目难度中等.

| A. | 烧杯 | B. | 容量瓶 | C. | 锥形瓶 | D. | 试管 |
| A. | NaCl | B. | FeCl2 | C. | FeCl3 | D. | CuCl2 |
| A. | 用渗析的方法除去NaCl溶液中含有的少量淀粉胶体 | |
| B. | 用加热、蒸发的方法可以除去粗盐中的CaCl2、MgCl2杂质 | |
| C. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液 |
| A. | 氢能可再生,没有污染,现已用作火箭和燃料电池的燃料 | |
| B. | 在环保领域,酸性或碱性废水的处理常常利用中和反应 | |
| C. | 为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 | |
| D. | 工业生产中,使用催化剂能加快化学反应速率,提高反应物的转化率 |
| A. | 13、1 | B. | 13、2 | C. | 11、1 | D. | 10、2 |
| A. | H2 | B. | NO2 | C. | NO | D. | N2O |