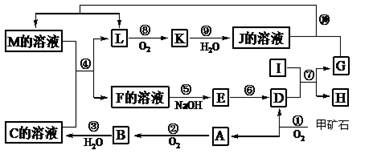
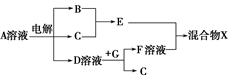
题目内容
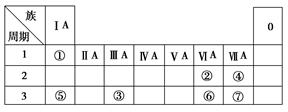
下表为长式周期表的一部分,其中的编号代表对应的元素。

根据上述表格中的十种元素填空:
1)表中属于ds区的元素是 (填编号)。
2)元素②与③形成的一种化合物是重要的化工原料,该化合物可用于人工降雨。有关该化合物分子的说法正确的是 。
3)金属性最强的主族元素是 (填元素名称)。
4)⑤、⑥、⑦的离子半径由小到大的顺序是 (填化学式)。
5)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的未成对电子数为 个; 该元素与元素①形成的分子X的空间构型为 。

根据上述表格中的十种元素填空:
1)表中属于ds区的元素是 (填编号)。
2)元素②与③形成的一种化合物是重要的化工原料,该化合物可用于人工降雨。有关该化合物分子的说法正确的是 。
| A.分子中含极性共价键 | B.含有1个σ键和2个π键 |
| C.属于非极性分子 | D.该化合物分子中,②原子采用sp2杂化 |
4)⑤、⑥、⑦的离子半径由小到大的顺序是 (填化学式)。
5)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的未成对电子数为 个; 该元素与元素①形成的分子X的空间构型为 。
(6分)
1)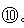 。2)A C。3)钙。4)Al3+<Cl-<S2-。
。2)A C。3)钙。4)Al3+<Cl-<S2-。
5)3;三角锥形。
1)
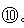 。2)A C。3)钙。4)Al3+<Cl-<S2-。
。2)A C。3)钙。4)Al3+<Cl-<S2-。5)3;三角锥形。
试题分析:(1)元素周期表中位于ds区的元素为第ⅠB、ⅡB族,故符合的为⑩元素铜;
(2)元素①为氢元素,元素③为碳元素,元素⑦氯元素,根据题意可知,2个氢原子与的2个碳原子形成的分子中为乙烯,杂化类型是sp杂化,碳元素和氯元素形成化合物为四氯化碳,化学键类型是极性共价键;
(3)⑧为铬元素,价电子排布为3d54s1,六个电子均为单电子,故单电子数为 6个;
(4)根据对角线法则,铍元素与铝元素性质相似,氢氧化铍也为两性氢氧化物,可以与氢氧化钠反应生成相应的偏铍酸盐,化学方程式为2NaOH+Be(OH)2═Na2BeO2+2H2O;
(5)计算晶胞中原子个数,晶体中晶胞重复出现,推算到晶体中的原子个数。
点评:本题考查了元素周期表中元素的分区;元素周期表中元素的位置;根据价电子数判断单电子个数;元素周期表中的对角线法则;晶胞及晶体中原子个数的计算。

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目