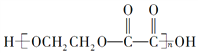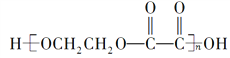题目内容
【题目】我国产铜主要取自黄铜矿(CuFeS2),随着矿石品位的降低和环保要求的提高,湿法炼铜的优势日益突出。该工艺的核心是黄铜矿的浸出,目前主要有氧化浸出、配位浸出和生物浸出三种方法。
Ⅰ.氧化浸出
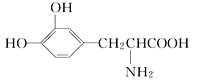
(1)在硫酸介质中用双氧水将黄铜矿氧化,测得有![]() 生成。
生成。
①该反应的离子方程式为____________________________________________。
②该反应在25~50℃下进行,实际生产中双氧水的消耗量要远远高于理论值,试分析其原因:_____________________________________________________。
Ⅱ.配位浸出
反应原理为:![]() (未配平)
(未配平)
(2)为提高黄铜矿的浸出率,可采取的措施有____________________(至少写出两点)。
(3)为稳定浸出液的pH,生产中需要向氨水中添加NH4Cl,构成NH3·H2O-NH4Cl缓冲溶液。某小组在实验室对该缓冲体系进行了研究:25℃时,向a mol·L-1的氨水中缓慢加入等体积0.02mol·L-1的NH4Cl溶液,平衡时溶液呈中性。则NH3·H2O的电离常数Kb=________(用含a的代数式表示);滴加NH4Cl溶液的过程中水的电离平衡________(填“正向”“逆向”或“不”)移动。
Ⅲ.生物浸出
在反应釜中加入黄铜矿、硫酸铁、硫酸和微生物,并鼓入空气,黄铜矿逐渐溶解,反应釜中各物质的转化关系如图所示。
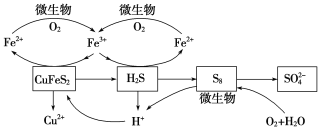
(4)在微生物的作用下,可以循环使用的物质有________(填化学式),微生物参与反应的离子方程式为______________________(任写一个)。
(5)假如黄铜矿中的铁元素最终全部转化为Fe3+,当有2mol ![]() 生成时,理论上消耗O2的物质的量为________。
生成时,理论上消耗O2的物质的量为________。
【答案】![]() H2O2受热分解;产物Cu2+、Fe3+催化H2O2分解等 提高氨水的浓度、提高氧压
H2O2受热分解;产物Cu2+、Fe3+催化H2O2分解等 提高氨水的浓度、提高氧压 ![]() 正向 Fe2(SO4)3,H2SO4
正向 Fe2(SO4)3,H2SO4  或
或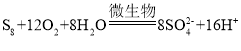 (任写一个) 4.25mol
(任写一个) 4.25mol
【解析】
(1)①CuFeS2中铜元素为+2价且为最高价态,铁元素为+2价,在酸性条件下能被双氧水氧化为Fe3+,S为-2价,可被氧化为SO42-,故反应的离子方程式为:2CuFeS2+17H2O2+2H+=2Cu2++2Fe3++4SO42-+18H2O;
②过氧化氢受热分解,且生成的Cu2+、Fe3+可催化过氧化氢分解;
(2)由反应原理可知,为提高浸出率,可将黄铜矿粉碎、增大氨水浓度、增大氧压等;
(3)混合溶液中c(NH4+)=0.02/2=0.01mol/L,c(OH-)=10-7mol/L, ;滴加氯化铵溶液促进水的电离,水的电离平衡正向移动;
;滴加氯化铵溶液促进水的电离,水的电离平衡正向移动;
(4)由关系图可知,可以循环使用的物质为Fe2(SO4)3、H2SO4;由二价铁转化为三价铁有微生物参与,离子方程式为 ;S8与O2和H2O反应也有微生物参与,离子方程式为
;S8与O2和H2O反应也有微生物参与,离子方程式为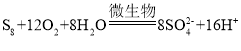 ;
;
(5)由题意知,当生成2mol SO42-时,有1mol Fe2+转化为Fe3+,Fe2+失去1mol电子,S2失去16mol电子,共失去17mol电子,则消耗氧气的物质的量为![]() ;
;

 计算高手系列答案
计算高手系列答案