题目内容
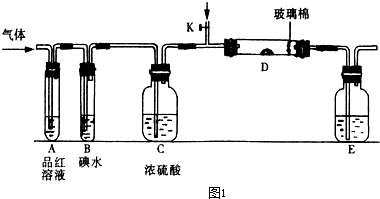
某同学设计如图1所示装置分别进行以下探究实验(夹持装置已略去,忽略滴入液体体积对气体体积的影响):
| 实验 | 药品 | 制取气体 | 量气管中液体 |
| Ⅰ | Cu、稀硝酸 | NO | H2O |
| Ⅱ | NaOH(s)、浓氨水 | NH3 | |
| Ⅲ | 电石、饱和食盐水 | C2H2 | H2O |
| Ⅳ | 镁铝合金、NaOH溶液 | H2 | H2O |
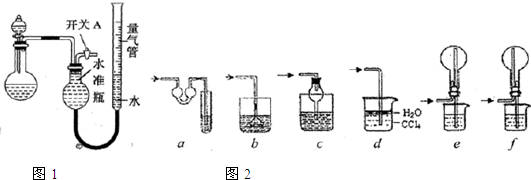
(1)实验过程中,使用分液漏斗滴加液体的操作是
(2)该同学认为实验I不可通过收集并测量NO气体的体积来探究铜样品的纯度,请你分析其中原因是
(3)实验Ⅲ烧瓶中发生反应的化学方程式是
(4)实验II中量气管中的液体最好是
a.浓NaOH溶液 b.氨水 c.煤油 d.氯化铵溶液
该实验剩余的NH3需吸收处理,以下各种尾气吸收装置中图2,适合于吸收NH3,而且能防止倒吸的有
(5)本实验应对量气管多次读数,读数时应注意:
①将实验装置恢复到室温,②
(6)实验Ⅳ获得以下数据(所有气体体积均己换算成标准状况):
| 编号 | 镁铝合金质量 | 量气管第1次读数 | 量气管第2次读数 |
| ① | 1.0g | 10.0mL | 347.5mL |
| ② | 1.0g | 10.0mL | 335.0mL |
| ③ | 1.0g | 10.0mL | 344.5mL |
分析:(1)分液漏斗加液时要注意内外空气相通,压强相等,液体才能顺利流下;
(2)实验Ⅰ装置中有空气,一氧化氮与空气反应生成二氧化氮,二氧化氮溶于水;
(3)实验Ⅲ用电石和水反应制取乙炔,乙炔可以燃烧,燃烧时火焰明亮并伴有浓烈的黑烟;
(4)氨气极易溶于水,量气管中的液体应该不含水且不与氨气反应,最好用煤油;极易溶于水的气体,若吸收时导管伸入水中,由于气体溶于水,导致装置内压强急剧降低,外界大气压压着液体进入,产生倒吸现象;
(5)对量气管读数时,首先等实验装置恢复到室温再进行下一步操作,然后调节量气管使左右液面相平,最后读数时视线与凹液面最低处相平;
(6)实验Ⅳ,铝和氢氧化钠反应,根据量气管的第二次读数-第一次读数=生成氢气的体积,求出生成氢气的平均值,再求出合金中铝的质量,最后计算出镁铝合金中铝的质量分数.
(2)实验Ⅰ装置中有空气,一氧化氮与空气反应生成二氧化氮,二氧化氮溶于水;
(3)实验Ⅲ用电石和水反应制取乙炔,乙炔可以燃烧,燃烧时火焰明亮并伴有浓烈的黑烟;
(4)氨气极易溶于水,量气管中的液体应该不含水且不与氨气反应,最好用煤油;极易溶于水的气体,若吸收时导管伸入水中,由于气体溶于水,导致装置内压强急剧降低,外界大气压压着液体进入,产生倒吸现象;
(5)对量气管读数时,首先等实验装置恢复到室温再进行下一步操作,然后调节量气管使左右液面相平,最后读数时视线与凹液面最低处相平;
(6)实验Ⅳ,铝和氢氧化钠反应,根据量气管的第二次读数-第一次读数=生成氢气的体积,求出生成氢气的平均值,再求出合金中铝的质量,最后计算出镁铝合金中铝的质量分数.
解答:解:(1)分液漏斗用于气体发生器中控制加液,也常用于互不相溶的几种液体的分离,加液时要注意内外空气相通,压强相等,液体才能顺利流下,具体操作为:打开分液漏斗上口的活塞(或将活塞上的凹槽与瓶口上的小孔对齐),旋开分液漏斗的旋塞,缓慢滴加;
故答案为:打开分液漏斗上口的活塞(或将活塞上的凹槽与瓶口上的小孔对齐),旋开分液漏斗的旋塞,缓慢滴加;
(2)一氧化氮与氧气反应生成二氧化氮,二氧化氮可与水反应生成一氧化氮和硝酸;装置Ⅰ中有空气,一氧化氮会与装置中的空气反应,生成的二氧化氮溶于水并与水反应,使测得的一氧化氮体积不准,所以不可以通过实验I收集并测量NO气体的体积来探究铜样品的纯度,
故答案为:NO会与装置中空气反应,生成NO2溶于水,使测得的NO气体体积不准;
(3)实验室用电石和水来制取乙炔,反应原理为:CaC2+2H2O→Ca(OH)2+C2H2↑,乙炔可以燃烧,乙炔燃烧时,火焰明亮并伴有浓烈的黑烟,这是因为乙炔中含碳的质量分数比乙烯高,碳没有完全燃烧的缘故,
故答案为:CaC2+2H2O→Ca(OH)2+C2H2↑;火焰明亮并伴有浓烈的黑烟;
(4)氨气为碱性气体,极易溶于水,量气管中的液体应该不含水且不与氨气反应,浓NaOH溶液、氨水、氯化铵溶液中含有水,氨气被水吸收,而氨气不溶于煤油,所以量气管中液体最好是煤油;
a、对于极易溶于水的气体,吸收装置中的导管外联双球状导管内伸入到液体中,液体进入双球内,防止进入前端装置,能防止倒吸,故a正确;
b、吸收装置中的导管下联漏斗,漏斗口伸入液面以下,易吸收易溶性气体,不能防止倒吸,故b错误;
c、对于极易溶于水的气体,吸收装置中的导管与干燥管连接,当水进入干燥管内,烧杯内液面下降低于导管口,液体又流落到烧杯中,能防止倒吸,故c正确;
d、氨气极易溶于水,不溶于四氯化碳,所以导管通入四氯化碳中,气泡向上到水层溶解,能防止倒吸,故d正确;
e、氨气极易溶于水,导管插入溶液中形成喷泉,进气管在烧瓶口,液体经进气管倒流入前端装置,产生倒吸,故e错误;
f、氨气极易溶于水,导管插入溶液中形成喷泉,进气管在烧瓶底部,液体不能流入前端装置,能防止倒吸,故f正确;
所以能防倒吸的吸收装置有acdf,
故答案为:c; a、c、d、f;
(5)根据PV=nRT,为保证测出来的气体体积是当时大气压下的体积,在读数时应注意:①将实验装置恢复到室温,②使量气管两端液面相平,因为相平说明两边液面上的压强是一样的,这样测出来的气体体积才是当时大气压下的体积,③视线与凹液面最低处相平,俯视或仰视会造成误差,
故答案为:使量气管和水准瓶两端液面相平;
(6)第2次测量数据误差较大,可不用,铝和氢氧化钠反应生成氢气的体积=
=336.0mL=0.336L
设生成0.336L氢气,需铝的质量为x
2Al+2NaOH+2H2O═2NaAlO2+3H2↑
54g 3×22.4L
x 0.336L
=
,解之得:x=0.27g
铝的质量分数=
×100%=27.0%,
故答案为:27.0%.
故答案为:打开分液漏斗上口的活塞(或将活塞上的凹槽与瓶口上的小孔对齐),旋开分液漏斗的旋塞,缓慢滴加;
(2)一氧化氮与氧气反应生成二氧化氮,二氧化氮可与水反应生成一氧化氮和硝酸;装置Ⅰ中有空气,一氧化氮会与装置中的空气反应,生成的二氧化氮溶于水并与水反应,使测得的一氧化氮体积不准,所以不可以通过实验I收集并测量NO气体的体积来探究铜样品的纯度,
故答案为:NO会与装置中空气反应,生成NO2溶于水,使测得的NO气体体积不准;
(3)实验室用电石和水来制取乙炔,反应原理为:CaC2+2H2O→Ca(OH)2+C2H2↑,乙炔可以燃烧,乙炔燃烧时,火焰明亮并伴有浓烈的黑烟,这是因为乙炔中含碳的质量分数比乙烯高,碳没有完全燃烧的缘故,
故答案为:CaC2+2H2O→Ca(OH)2+C2H2↑;火焰明亮并伴有浓烈的黑烟;
(4)氨气为碱性气体,极易溶于水,量气管中的液体应该不含水且不与氨气反应,浓NaOH溶液、氨水、氯化铵溶液中含有水,氨气被水吸收,而氨气不溶于煤油,所以量气管中液体最好是煤油;
a、对于极易溶于水的气体,吸收装置中的导管外联双球状导管内伸入到液体中,液体进入双球内,防止进入前端装置,能防止倒吸,故a正确;
b、吸收装置中的导管下联漏斗,漏斗口伸入液面以下,易吸收易溶性气体,不能防止倒吸,故b错误;
c、对于极易溶于水的气体,吸收装置中的导管与干燥管连接,当水进入干燥管内,烧杯内液面下降低于导管口,液体又流落到烧杯中,能防止倒吸,故c正确;
d、氨气极易溶于水,不溶于四氯化碳,所以导管通入四氯化碳中,气泡向上到水层溶解,能防止倒吸,故d正确;
e、氨气极易溶于水,导管插入溶液中形成喷泉,进气管在烧瓶口,液体经进气管倒流入前端装置,产生倒吸,故e错误;
f、氨气极易溶于水,导管插入溶液中形成喷泉,进气管在烧瓶底部,液体不能流入前端装置,能防止倒吸,故f正确;
所以能防倒吸的吸收装置有acdf,
故答案为:c; a、c、d、f;
(5)根据PV=nRT,为保证测出来的气体体积是当时大气压下的体积,在读数时应注意:①将实验装置恢复到室温,②使量气管两端液面相平,因为相平说明两边液面上的压强是一样的,这样测出来的气体体积才是当时大气压下的体积,③视线与凹液面最低处相平,俯视或仰视会造成误差,
故答案为:使量气管和水准瓶两端液面相平;
(6)第2次测量数据误差较大,可不用,铝和氢氧化钠反应生成氢气的体积=
| (346.3-10.0)+(345.7-10.0) |
| 2 |
设生成0.336L氢气,需铝的质量为x
2Al+2NaOH+2H2O═2NaAlO2+3H2↑
54g 3×22.4L
x 0.336L
| 54g |
| x |
| 3×22.4L |
| 0.336L |
铝的质量分数=
| 0.27g |
| 1.0 |
故答案为:27.0%.
点评:通过回答本题知道了分液漏斗的使用,测定气体体积的方法,了解了点燃可燃性气体前要检验纯度,极易溶于水的气体的防倒吸.计算时要使用合理数据,把不合理数据舍去.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
如图1所示是实验室中制取气体的一种简易装置.

(1)请简述检验它的气密性的方法.
(2)利用如图1所示装置制取气体时,可适用的反应条件和反应物状态为 .
某同学设计如图2所示装置,用粗铁粒与16.9%稀硝酸反应制取NO气体并探究产物中铁的价态.请回答有关问题.
(3)已知16.9%稀硝酸的密度为1.10g?cm-3,则其物质的量浓度为 (计算结果保留两位小数).若用63%的硝酸配制16.9%稀硝酸500mL,所需的玻璃仪器有量筒、玻璃棒、烧杯、 .
(4)实验开始时,先打开止水夹a、关闭止水夹b时,A装置的干燥管中观察到的现象是 .B装置烧杯中液体的作用是 .当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体.
(5)现有仪器和药品:试管和胶头滴管,0.1mol?L-1 KSCN溶液、0.2mol?L-1酸性KMnO4溶液、0.1mol?L-1 KI溶液、氯水等.请你设计一个简单实验,探究A装置烧杯里完全反应后含铁可能的价态,填写下列实验报告.

(1)请简述检验它的气密性的方法.
(2)利用如图1所示装置制取气体时,可适用的反应条件和反应物状态为
某同学设计如图2所示装置,用粗铁粒与16.9%稀硝酸反应制取NO气体并探究产物中铁的价态.请回答有关问题.
(3)已知16.9%稀硝酸的密度为1.10g?cm-3,则其物质的量浓度为
(4)实验开始时,先打开止水夹a、关闭止水夹b时,A装置的干燥管中观察到的现象是
(5)现有仪器和药品:试管和胶头滴管,0.1mol?L-1 KSCN溶液、0.2mol?L-1酸性KMnO4溶液、0.1mol?L-1 KI溶液、氯水等.请你设计一个简单实验,探究A装置烧杯里完全反应后含铁可能的价态,填写下列实验报告.
| 实验步骤 | 操作 | 现象与结论 |
| 第一步 | 取少量液体装于试管,向试管中滴入几滴KSCN溶液. | |
| 第二步 | 若溶液紫色褪去,则说明含有Fe2+; 若无明显变化,则说明不含Fe2+. |