题目内容
【题目】依据氧化还原反应:2Ag+(aq)+Zn(s)═Zn2+(aq)+2Ag(s) 设计的原电池如图所示.
请回答下列问题:
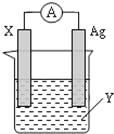
(1)X电极上电子 (填“流入”或“流出”);X电极上产生的现象是 ;电解质溶液Y是 (填化学式);
(2)银电极为电池的 正 极,发生的电极反应为 ;X电极上发生的反应类型为 ;(填“氧化反应”或“还原反应”)
【答案】(1)流出;锌逐渐溶解;AgNO3;
(2)正; Ag++e﹣=Ag; 氧化反应.
【解析】
试题分析:根据反应“2Ag+(aq)+Zn(s)=Zn2+(aq)+2Ag(s)”分析,在反应中,Zn被氧化,失电子,应为原电池的负极,电极反应为Zn﹣2e﹣=Zn2+,则正极为活泼性较Zn弱的Ag,Ag+在正极上得电子被还原,电极反应为Ag++e﹣=Ag,电解质溶液为AgNO3,结合电极方程式解答该题.
解:(1)由反应“2Ag+(aq)+Zn(s)=Zn2+(aq)+2Ag(s)”可知,在反应中,Zn被氧化,失电子,锌逐渐溶解,应为原电池的负极,电子从负极流出,Ag+在正极上得电子被还原,电解质溶液为AgNO3,
故答案为:流出;锌逐渐溶解;AgNO3;
(2)正极为活泼性较Zn弱的Ag,Ag+在正极上得电子被还原,电极反应为Ag++e﹣=Ag,X为负极,发生氧化反应,反应式为:Zn﹣2e﹣=Zn2+;
故答案为:正; Ag++e﹣=Ag; 氧化反应.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目