题目内容
【题目】将0.4g NaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1molL﹣1稀盐酸.下列图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
A.
B.
C.
D.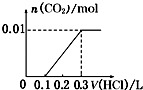
【答案】C
【解析】解:对NaOH和Na2CO3混合配成的溶液,当滴加盐酸时,先发生NaOH+HCl=NaCl+H2O,再发生Na2CO3+HCl=NaCl+NaHCO3,最后发生NaHCO3+HCl=NaCl+CO2↑+H2O,此时才有二氧化碳气体生成.
A、0.1mol盐酸与氢氧化钠反应没有气体生成,但碳酸钠与盐酸反应生成碳酸氢钠时也没有气体生成,则图象与反应不符,故A错误;
B、图象中开始反应即有气体生成,与反应不符,故B错误;
C、向NaOH和Na2CO3混合溶液中滴加盐酸时,首先和NaOH反应生成水和氯化钠,当滴入0.1L时,两者恰好反应完全;继续滴加时,盐酸和Na2CO3开始反应,首先发生HCl+Na2CO3=NaHCO3+NaCl,不放出气体,当再加入0.1L时,此步反应进行完全;继续滴加时,发生反应:NaHCO3+HCl=NaCl+H2O+CO2↑;此时开始放出气体,正好与图象相符,故C正确;
D、因碳酸钠与盐酸的反应分步完成,则碳酸钠与盐酸先反应生成碳酸氢钠和氯化钠,此时没有气体生成,则图象与反应不符,故D错误;
故选C.
对NaOH和Na2CO3混合配成的溶液,当滴加盐酸时,先发生NaOH+HCl=NaCl+H2O,再发生Na2CO3+HCl=NaCl+NaHCO3,最后发生NaHCO3+HCl=NaCl+CO2↑+H2O,此时才有二氧化碳气体生成,利用物质的量的关系并结合图象即可解答.

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】钛合金烤瓷牙是目前国内使用最为普遍的一种烤瓷牙,TiCl4是生产金属钛的原料.
(1)工业上主要用TiO2氯化的方法来制取TiCl4
①有人拟用以下氯化反应来制取TiCl4:TiO2(s)+2Cl2(g)TiCl4(l)+O2(g),写出实验室用二氧化锰与浓盐酸反应制取Cl2的离子方程式 .
②工业上通常往TiO2和Cl2反应体系中加入碳单质,在一定条件下制取TiCl4 , 从化学平衡的角度解释此方法能顺利制取TiCl4的原因 .
(2)某化学实验小组以TiO2和足量 CCl4为原料制取TiCl4 , 装置如图1所示: 
如表是有关物质的性质:
物质 | 熔点/℃ | 沸点/℃ | 其他 |
CCl4 | ﹣23 | 76.8 | 与TiCl4互溶 |
TiCl4 | ﹣25 | 136 | 遇潮湿空气产生白雾 |
①实验开始时先点燃A处的酒精灯,待C中烧瓶里有液滴出现时再点燃B处的酒精灯,其主要目的是 .
②本实验中仪器a采用题给的加热方式的突出优点是 .
③B中CCl4与TiO2发生反应的化学方程式是 .
④欲分离C装置中的TiCl4 , 应采用的实验操作为(填操作名称).
⑤若将反应过程中生成的气体X(足量)缓缓通入Ba( OH)2和NaOH的混合稀溶液中,生成沉淀的物质的量(n)和 通入气体X的体积(V)的关系如图2所示,若混合溶液中Ba( OH)2和2NaOH的物质的量之比为1:1,则b点溶液中溶质主要成分的化学式为 , 从b点到c点,沉淀减少过程中发生反应的离子方程式为 .
【题目】毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl22H2O的流程如图: 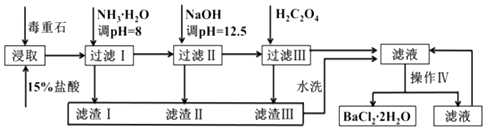
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀的pH | 11.9 | 9.1 | 1.9 |
完全沉淀的pH | 13.9 | 11.1 | 3.2 |
已知:Ksp(BaC2O4)=1.6×10﹣7 , Ksp(CaC2O4)=2.3×10﹣9
(1)实验室用37%的盐酸配制1mol/L盐酸,下列仪器中,不需要使用的是
a.容量瓶 b.量筒 c.烧杯 d.滴定管
为了加快毒重石的酸浸速率,可以采取的措施有(至少两条).
(2)加入氨水调节溶液pH=8的目的是 . 滤渣Ⅱ中含(填化学式).加入H2C2O4时应避免过量,原因是 .
(3)操作Ⅳ的步骤是:、过滤.
(4)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行.
已知:2CrO42﹣+2H+=Cr2O72﹣+H2O;Ba2++CrO42﹣=BaCrO4↓
步骤Ⅰ:移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b molL﹣1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL.
步骤Ⅱ:移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b molL﹣1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL.通过计算,氯化钡溶液浓度为molL﹣1(用含字母的式子表示).