题目内容
24gSO32-恰好将1.204×1023个XO4-离子还原,则x元素在还原产物中的化合价是( )A.+1
B.+2
C.+3
D.+4
【答案】分析:SO32-将XO4-离子还原,则SO32-被氧化为SO42-,XO4-离子中x元素的化合价为+7,令x元素在还原产物中的化合价为a,根据电子转移守恒列方程计算a值.
解答:解:24gSO32-的物质的量为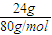 =0.3mol,1.204×1023个XO4-离子的物质的量为0.2mol.
=0.3mol,1.204×1023个XO4-离子的物质的量为0.2mol.
SO32-将XO4-离子还原,则SO32-被氧化为SO42-,S元素化合价由+4价升高为+6价,XO4-离子中x元素的化合价为+7,令x元素在还原产物中的化合价为a,根据电子转移守恒,则:
0.3mol×(6-4)=0.2mol×(7-a)
解得:a=+4.
故选D.
点评:本题考查氧化还原反应计算,难度中等,判断SO32-被氧化为SO42-是解题关键,注意守恒思想在氧化还原反应计算中的应用.
解答:解:24gSO32-的物质的量为
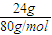 =0.3mol,1.204×1023个XO4-离子的物质的量为0.2mol.
=0.3mol,1.204×1023个XO4-离子的物质的量为0.2mol.SO32-将XO4-离子还原,则SO32-被氧化为SO42-,S元素化合价由+4价升高为+6价,XO4-离子中x元素的化合价为+7,令x元素在还原产物中的化合价为a,根据电子转移守恒,则:
0.3mol×(6-4)=0.2mol×(7-a)
解得:a=+4.
故选D.
点评:本题考查氧化还原反应计算,难度中等,判断SO32-被氧化为SO42-是解题关键,注意守恒思想在氧化还原反应计算中的应用.

练习册系列答案
相关题目