题目内容
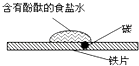
【题目】市场上出售的“热敷袋”主要成分是铁屑、碳粉、木屑和少量氯化钠、水等。热敷袋使用前,用塑料袋使之与空气隔绝,使用时打开塑料袋轻轻揉搓就会放出热量,使用完后,袋内有大量铁锈存在。
(1)“热敷袋”放出的热量是利用了铁放出的热量。
(2)碳粉的主要作用是。
(3)氯化钠的主要作用是。
(4)写出电极反应,正极 ,
负极 , 若铁锈的主要成分为Fe2O3 , 写出产生Fe2O3的有关反应方程式
。
【答案】
(1)氧化
(2)与铁屑、氯化钠溶液构成原电池,加速铁屑氧化
(3)溶于水形成电解质溶液
(4)2H2O+O2+4e-===4OH-;Fe-2e-===Fe2+;Fe2++2OH-===Fe(OH)2↓,4Fe(OH)2+O2+2H2O===4Fe(OH)3 , 2Fe(OH)3 ![]() Fe2O3+3H2O
Fe2O3+3H2O
【解析】首先铁应为负极:Fe-2e-===Fe2+ , 正极上必然为空气中的氧气得电子:O2+4e-+2H2O===4OH-;使用过程中放出大量热必定为Fe被氧化而产生的,最后得到大量铁锈,O2在反应中得电子变为O2-与水生成OH- , 结合Fe2+生成Fe(OH)2转化为Fe(OH)3。加入碳粉自然是提供形成原电池的正极,而加入NaCl溶于水就是为了形成电解质溶液。
【考点精析】关于本题考查的金属的电化学腐蚀与防护,需要了解金属的保护:涂保护层;保持干燥;改变金属的内部结构,使其稳定;牺牲阳极的阴极保护法即用一种更为活泼的金属与要保护的金属构成原电池;外加电源法才能得出正确答案.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目