题目内容
如图是元素周期表的框架图,请根据下面提问回答下列问题:(2)请用物质的名称填写.
硬度最大的是单质是 ,密度最小的金属是 ;通常状况呈液态的非金属单质是 ,地壳中含量最多的金属元素是 .
(3)在原子序数为1~18号元素中,请用化学式填写.
与水反应最剧烈的金属单质是 ;元素的气态氢化物最稳定的是 ;元素的最高价氧化物所对应的水化物其酸性最强的是 ;原子半径最大的金属与原子半径最小的非金属形成的化合物是 ,并用电子式表示其形成过程: .
(4)在原子序数为1~18号元素中,请按要求填写下列空白.
由两种元素组成的淡黄色化合物的电子式为 ;空气中含量最高的物质的结构式为 ;常温下为气态,固态常用于人工降雨的氧化物的电子式为 ;某元素最高价氧化物的水化物与其气态氢化物反应生成一种盐,该盐的化学式为 ,该化合物中的化学键类型是 .
【答案】分析:(1)根据元素周期表的结构补全;
(2)硬度最大的是单质是金刚石,密度最小的金属是锂;通常状况呈液态的非金属单质是 溴,地壳中含量最多的金属元素是铝;
(3)1~18号中,与水反应最剧烈的金属是最活泼的金属,是Na;非金属性最强的元素的气态氢化物最稳定;非金属性越强,元素的最高价氧化物对应水化物的酸性越强,F无正化合价;原子半径最大的金属是Na与原子半径最小的非金属是H,两者形成的物质为离子化合物;
(4)1~18号元素中,由两种元素组成的淡黄色化合物是过氧化钠,为离子化合物;空气中含量最高的物质是氮气,两个N原子通过3对共用电子对连接;固态常用于人工降雨的氧化物为
CO2,碳氧之间以2对共用电子对连接;N元素最高价氧化物的水化物与其气态氢化物反应生成盐,该盐为NH4NO3,含有离子键和极性共价键.
解答:解:(1)根据元素周期表的结构补全,如图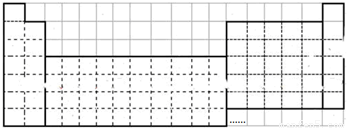 ,
,
故答案为: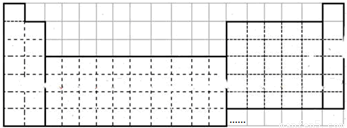 ;
;
(2)硬度最大的是单质是金刚石,密度最小的金属是锂;通常状况呈液态的非金属单质是 溴,地壳中含量最多的金属元素是铝,
故答案为:金刚石;锂;溴;铝;
(3)1~18号中,与水反应最剧烈的金属是Na;态氢化物最稳定的是HF;最高价氧化物所对应的水化物其酸性最强的是 HClO4;原子半径最大的金属是Na与原子半径最小的非金属是H,两者形成的物质是NaH,NaH是离子化合物,形成过程为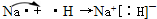 ,
,
故答案为:Na;HF;HClO4;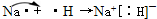 ;
;
(4)过氧化钠的电子式为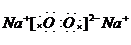 ;氮气的结构式为N≡N;CO2的电子数为
;氮气的结构式为N≡N;CO2的电子数为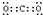 ;N元素最高价氧化物的水化物与其气态氢化物反应生成盐,该盐为NH4NO3,含有离子键和极性共价键.
;N元素最高价氧化物的水化物与其气态氢化物反应生成盐,该盐为NH4NO3,含有离子键和极性共价键.
故答案为: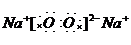 ;N≡N;
;N≡N;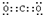 ;NH4NO3;离子键和极性共价键.
;NH4NO3;离子键和极性共价键.
点评:本题以元素周期表为载体,主要考查元素周期表结构、化学用语等,难度不大,加强基础知识的记忆.
(2)硬度最大的是单质是金刚石,密度最小的金属是锂;通常状况呈液态的非金属单质是 溴,地壳中含量最多的金属元素是铝;
(3)1~18号中,与水反应最剧烈的金属是最活泼的金属,是Na;非金属性最强的元素的气态氢化物最稳定;非金属性越强,元素的最高价氧化物对应水化物的酸性越强,F无正化合价;原子半径最大的金属是Na与原子半径最小的非金属是H,两者形成的物质为离子化合物;
(4)1~18号元素中,由两种元素组成的淡黄色化合物是过氧化钠,为离子化合物;空气中含量最高的物质是氮气,两个N原子通过3对共用电子对连接;固态常用于人工降雨的氧化物为
CO2,碳氧之间以2对共用电子对连接;N元素最高价氧化物的水化物与其气态氢化物反应生成盐,该盐为NH4NO3,含有离子键和极性共价键.
解答:解:(1)根据元素周期表的结构补全,如图
 ,
,故答案为:
 ;
;(2)硬度最大的是单质是金刚石,密度最小的金属是锂;通常状况呈液态的非金属单质是 溴,地壳中含量最多的金属元素是铝,
故答案为:金刚石;锂;溴;铝;
(3)1~18号中,与水反应最剧烈的金属是Na;态氢化物最稳定的是HF;最高价氧化物所对应的水化物其酸性最强的是 HClO4;原子半径最大的金属是Na与原子半径最小的非金属是H,两者形成的物质是NaH,NaH是离子化合物,形成过程为
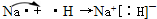 ,
,故答案为:Na;HF;HClO4;
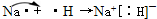 ;
;(4)过氧化钠的电子式为
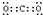 ;N元素最高价氧化物的水化物与其气态氢化物反应生成盐,该盐为NH4NO3,含有离子键和极性共价键.
;N元素最高价氧化物的水化物与其气态氢化物反应生成盐,该盐为NH4NO3,含有离子键和极性共价键.故答案为:
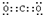 ;NH4NO3;离子键和极性共价键.
;NH4NO3;离子键和极性共价键.点评:本题以元素周期表为载体,主要考查元素周期表结构、化学用语等,难度不大,加强基础知识的记忆.

练习册系列答案
相关题目







