题目内容
12.下列溶液中溶质的物质的量浓度为1mol/L的是( )| A. | 将40gNaOH溶解于1L水中 | |
| B. | 将22.4L氯化氢气体溶于水配成1L溶液 | |
| C. | 将1L 10mol/L 的浓盐酸与9L水混合 | |
| D. | 将10gNaOH溶解于水中配成250ml溶液 |
分析 A.体积指溶液体积不是溶剂体积;
B.根据温度、压强对气体摩尔体积的影响分析判断;
C.根据不同液体混合时体积能否直接加和判断;
D.质量换算物质的量,依据浓度概念计算得到.
解答 解:A.体积指溶液体积不是溶剂体积,所以40gNaOH溶解于1L水中配成的NaOH溶液浓度不是1mol/L,故A错误;
B.气体摩尔体积受温度和压强的影响,温度越高,气体摩尔体积越大,标况下,22.4LHCl的物质的量是1mol,常温常压下,22.4LHCl的物质的量小于1mol,所以常温常压下将22.4LHCl气体溶于水配成1L的盐酸溶液的物质的量浓度不是1mol/L,故B错误;
C.1L10mol/L的浓盐酸与9L水混合配成溶液的体积不是10L,所以混合后溶液的物质的量浓度不是1mol/L,故C错误;
D.10gNaOH物质的量为0.25mol,溶解后配制为250ml的溶液,其浓度为1 mol•L-1,故D正确.
故选D.
点评 本题考查了溶液浓度的计算应用,主要是溶液混合后体积变化的判断,浓度概念的理解分析,题目难度中等.

练习册系列答案
相关题目
2.下列说法正确的是( )
| A. | 溴乙烷中碳溴键极性较强,在碱的水溶液中易发生取代反应 | |
| B. | 乙醇分子中碳氧键键能比碳碳键键能小,所以易断裂而发生化学反应 | |
| C. | 甲醛常温下为无色无味液体,其水溶液即福尔马林 | |
| D. | 醋酸又称为冰醋酸,在浓硫酸条件下可以断裂氧氢键和乙醇发生酯化反应 |
3.下列说法正确的是( )
| A. | CH4(g)+$\frac{3}{2}$O2(g)═CO(g)+2H2O(l)△H═-akJ•mol-1,这里△H代表燃烧热 | |
| B. | 在25℃、101 kPa,1 mol S和2 mol S的燃烧热相等 | |
| C. | CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,所以CO的燃烧反应一定是吸热反应 | |
| D. | 101 kPa时,1mol碳燃烧所放出的热量为碳的燃烧热 |
20.下列说法正确的是( )
| A. | 乙烯、甲苯、苯酚均能与溴水反应 | |
| B. | 乙炔、苯、苯酚均能使酸性高锰酸钾溶液褪色 | |
| C. | 乙醇、苯酚、乙酸都能与氢氧化钠溶液反应 | |
| D. | 乙醇、苯酚、乙酸都能与钠反应,且在相同条件下剧烈程度依次增大 |
7.下列操作达不到预期目的是( )
①石油分馏时把温度计插入液面以下
②用溴水除去乙烯中混有的SO2气体
③用乙醇与3mol•L-1的H2SO4混合共热到170℃以上制乙烯
④将苯和浓溴水混合后加入Fe粉制溴苯
⑤将饱和食盐水滴入盛有电石的烧瓶中制乙炔.
①石油分馏时把温度计插入液面以下
②用溴水除去乙烯中混有的SO2气体
③用乙醇与3mol•L-1的H2SO4混合共热到170℃以上制乙烯
④将苯和浓溴水混合后加入Fe粉制溴苯
⑤将饱和食盐水滴入盛有电石的烧瓶中制乙炔.
| A. | ①④ | B. | ③⑤ | C. | ②③④⑤ | D. | ①②③④ |
17.具备基本的化学实验技能是进行科学探究的基础和保证.下列有关实验操作正确的是( )
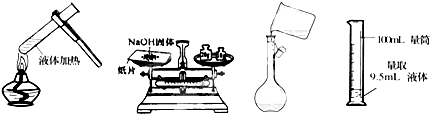

| A. | 给液体加热 | B. | 称取NaOH固体 | C. | 转移溶液 | D. | 量取液体 |
4.下列各组物质,其中有三组同时属于碱或同时属于酸性氧化物或同时属于混合物,另一组则不符合上述特点,该组物质是( )
| A. | 烧碱和熟石灰 | B. | 烧碱和纯碱 | ||
| C. | 碘水和碘酒 | D. | 二氧化碳和二氧化硫 |
1.下列在蒸发实验中需要的仪器是( )
| A. | 试管 | B. | 胶头滴管 | C. | 玻璃棒 | D. | 漏斗 |
2.烷烃中碳原子可以分成四类:只和一个碳原子相连的碳叫伯碳原子,和两个碳原子相连的碳叫仲碳原子,和三个碳原子相连的碳叫叔碳原子,和四个碳原子相连的碳叫季碳原子,由此推断,下列烷烃分子中含有季碳原子的是( )
| A. | 异戊烷 | B. | 2-甲基-3-乙基戊烷 | ||
| C. | 2-甲基丙烷 | D. | 2,3-二甲基-3-乙基戊烷 |