题目内容
【题目】室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如下图所示。下列说法正确的是( )

A. HA的酸性比HB的酸性弱
B. a点溶液的导电性比c点溶液的导电性弱
C. 若两溶液无限稀释,则它们的c(H+)相等
D. 对a、b两点溶液同时升高温度,则c(A-)/ c(B-)增大
【答案】C
【解析】从图中可以看出,酸HA稀释至1000倍后,pH有2增至5,所以HA为强酸,而酸HB pH增加不到3个单位,HB为弱酸,所以A错误。a比c点H+浓度大,A-浓度也大,所以a点溶液导电性更强,B错误。无限稀释后,溶液pH接近7,c(H+)=1×10-7mol/L,C正确。升高温度后,HA溶液中离子浓度变化可以忽略,而弱酸HB电离程度增大, c(B-)增大,c(A-)/ c(B-)减小,D错误。

 阅读快车系列答案
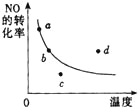
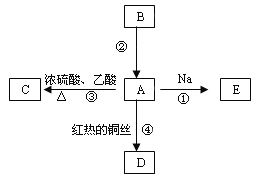
阅读快车系列答案【题目】Ⅰ.工业上可用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡 常数 | 温度/℃[ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) | K3 | ||
(1)据反应①与②可推导出K1、K2与K3之间的关系,则K3=________(用K1、K2表示)。500℃时测得反应 ③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为0.8、0.1、0.3、0.15,则此时v正________v逆(填“>”、“=”或“<”)。
(2)在3L容积可变的密闭容器中发生反应②,已知c(CO)—反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是_______________。 当曲线Ⅰ变为曲线Ⅲ时,改变的条件是______________。

Ⅱ.利用CO和H2可以合成甲醇,反应原理为CO(g)+2H2(g) ![]() CH3OH(g)。一定条件下,在容积为VLspan>的密闭容器中充入amolCO与2amolH2合成甲醇,平衡转化率与温度、压强的关系如下图所示。
CH3OH(g)。一定条件下,在容积为VLspan>的密闭容器中充入amolCO与2amolH2合成甲醇,平衡转化率与温度、压强的关系如下图所示。
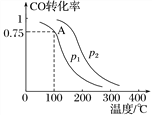
(1)p1________p2(填“>”、“<”或“=”),理由是_________。
(2)该甲醇合成反应在A点的平衡常数K=_________(用a和V表示)。
(3)下列措施中能够同时满足增大反应速率和提高CO转化率的是________(填字母)。
A.使用高效催化剂 B.降低反应温度
C.增大体系压强 D.不断将CH3OH从反应混合物中分离出来