题目内容
将5.000gNaCl、NaBr、CaCl2的混合物溶于水,通入氯气充分反应,然后把溶液蒸干并灼烧,得残留物4.914g.灼烧后的残留物再溶于水,并加足量的Na2CO3溶液,所得沉淀经干燥后质量为0.270g.求混合物中各化合物的质量百分组成.
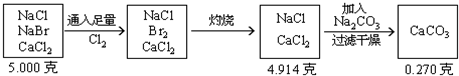
分析:根据题意可列出下图示,帮助审清题意,找出思路和解法.
 ,根据反应的关系式计算.
,根据反应的关系式计算.
 ,根据反应的关系式计算.
,根据反应的关系式计算.解答:解:根据题意可列出下图示,

根据图示可分析:
CaCO3的质量为0.270g,由它可求出CaCl2的质量,
CaCl2-----------CaCO3
111 100
x 0.270g
x=
=0.300g,
混合物中通入Cl2
2NaBr+Cl2=2NaCl+Br2 质量减小
206 117 206-117=89
y 5.000g-4.914g=0.086g
y=0.200g,
NaCl的质量=5.000-0.200-0.300=4.500(g),
各组分的百分含量:w(NaCl)=
×100%=90%,
w(NaBr)=
×100%=4%,
w(CaCl2)=
×100%=6%,
答:混合物中各化合物的质量百分组成为:w(NaCl)=90%,w(NaBr)=4%,w(CaCl2)=6%.

根据图示可分析:
CaCO3的质量为0.270g,由它可求出CaCl2的质量,
CaCl2-----------CaCO3
111 100
x 0.270g
x=
| 111×0.270g |
| 100 |
混合物中通入Cl2
2NaBr+Cl2=2NaCl+Br2 质量减小
206 117 206-117=89
y 5.000g-4.914g=0.086g
y=0.200g,
NaCl的质量=5.000-0.200-0.300=4.500(g),
各组分的百分含量:w(NaCl)=
| 4.500g |
| 5 |
w(NaBr)=
| 0.200g |
| 5 |
w(CaCl2)=
| 0.300g |
| 5 |
答:混合物中各化合物的质量百分组成为:w(NaCl)=90%,w(NaBr)=4%,w(CaCl2)=6%.
点评:本题考查混合物的计算,题目难度中等,注意根据反应的关系式计算.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目