题目内容
NaNO2是一种食品添加剂,它能致癌。酸性高锰酸钾溶液与亚硝酸钠的反应方程式是:MnO4- + NO2- + →Mn2+ + NO3- + H2O。下列叙述中正确的是
→Mn2+ + NO3- + H2O。下列叙述中正确的是
 →Mn2+ + NO3- + H2O。下列叙述中正确的是
→Mn2+ + NO3- + H2O。下列叙述中正确的是| A.该反应中NO2-被还原 |
| B.反应过程中溶液的pH变小 |
| C.生成1molNaNO3需要消耗0.4molKMnO4 |
D. 中的粒子是OH- 中的粒子是OH- |
C
试题分析:反应中氮元素的化合价从+3价升高到+5价,失去2个电子,被氧化,做还原剂,A不正确;Mn元素的化合价从+7价降低到+2价,得到5个电子,根据电子的得失守恒可知,氧化剂和还原剂的物质的量之比是2︰5,所以选项C正确;再根据电荷守恒可知,反应前消耗氢离子,所以B和D都是错误的,答案选C。
点评:在判断氧化还原反应时关键是准确标出元素的化合价,然后根据相应的概念进行。而在氧化还原反应的计算中,关键是利用好电子得失守恒这一关系式。

练习册系列答案
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
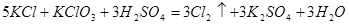 ,下列说法不正确的是( )
,下列说法不正确的是( )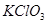 是氧化剂
是氧化剂 既不是氧化剂又不是还原剂
既不是氧化剂又不是还原剂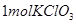 参加反应时有
参加反应时有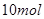 电子转移
电子转移